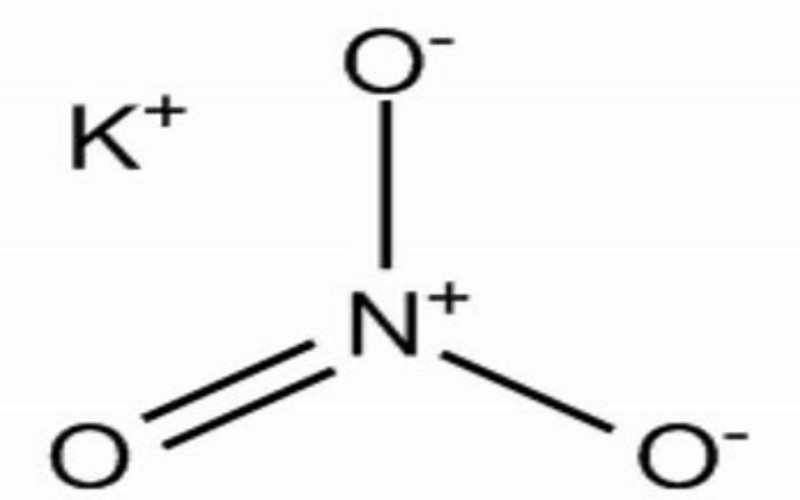
Нитрат калия (KNO₃)7757-79-1
Физические свойства
- Внешний вид: Бесцветные прозрачные кристаллы или белый гранулированный порошок.
- Плотность: 2,11 г/см³ при 20°C.
- Температура плавления: 334°C.
- Температура кипения: разлагается при 400°C, выделяя кислород.
- Растворимость:
- Растворимость в воде: 13,3 г/100 мл при 0°C, 247 г/100 мл при 100°C.
- Слабо растворим в этаноле, растворим в глицерине и жидком аммиаке.
Химические свойства
- Окислитель: Нитрат калия является сильным окислителем и может бурно реагировать с восстановителями, органическими материалами и порошкообразными металлами.
- Стабильность: Стабилен при комнатной температуре, но разлагается при высоких температурах, выделяя токсичные оксиды азота (NOₓ).
Использует
- Сельское хозяйство: Используется в качестве удобрения, обеспечивая как азот, так и калий (13% N, 46% K₂O) без хлора.
- Пиротехника и взрывчатые вещества: ключевой компонент пороха, фейерверков и ракетного топлива.
- Пищевая промышленность: используется в качестве консерванта и фиксатора цвета в мясе.
- Медицинское применение: исторически использовался в качестве мочегонного средства и для лечения гипертонии; В настоящее время используется в зубных пастах для снижения чувствительности зубов.
- Другое промышленное применение: используется в производстве стекла, спичек и в качестве флюса в металлургии.
Безопасность и опасности
- Опасность для здоровья: Вдыхание или проглатывание может вызвать раздражение глаз, носа и горла. Хроническое воздействие может привести к анемии и метгемоглобинемии.
- Риск возгорания и взрыва: Нитрат калия является мощным окислителем и может ускорить горение. Он представляет значительный риск возгорания и взрыва при смешивании с органическими материалами или восстановителями.
- Хранение и обращение: Хранить в прохладном, сухом месте вдали от органических материалов и восстановителей. При обращении используйте защитные средства.
Экологические соображения
- Экотоксичность: Имеются ограниченные данные, но в целом считается, что она вредна для водной флоры и фауны.
- Утилизация: Утилизировать в соответствии с местными нормами во избежание загрязнения окружающей среды.
Методы производства
- Коммерческое производство: Нитрат калия обычно получают путем реакции хлорида калия с азотной кислотой при высоких температурах.
- Альтернативный метод: Его также можно приготовить путем смешивания горячих насыщенных растворов хлорида калия и нитрата натрия с последующей кристаллизацией.
Наша компания специализируется на опасных химикатах, легковоспламеняющихся и взрывчатых химикатах, токсичных химикатах (легальный экспорт), сверхчистых и высокочистых реагентах. Добро пожаловать к нам.
Упаковка и доставка