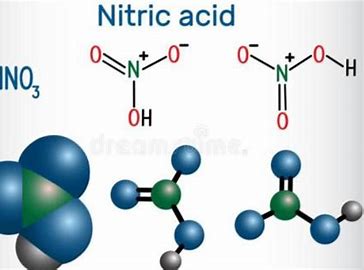
7697-37-2/حمض النيتريك
الحمض النيتري، كمعلقة كيميائية مهمة، يستخدم على نطاق واسع في العديد من المجالات. في ما يلي، سوف نقدم وصفًا مفصلاً عنتفاعلاته الكيميائية ومكافحة التأثيرات السريرية وآخرjena.
I.تفاعلات كيميائية للحمض النيتري
(I)تفاعل الإسترية
يمكن أن يتفاعل حمض النيتري مع الكحول فيتفاعل إستري لFORMATION النترات المقابلة. فيما يتعلق بنمط العمل، في الماضي، كان من المفترض أن يولدتفاعل الإسترية المتمثل في حمض النيتري中间体 كربوكاتيونية. بمناسبة الحاجة، يصف العديد من المراجع نمط العمل بتفاعل إسترية فيشر، أي، “ي فقد الحمض مجموعة هيدروكسيل وي فقد الكحول ذرة هيدروجين”، وهو نفس نمط عمل الإسترية للحمض الكربوكسلي. على سبيل المثال، في إعداد النتروغليسرين، يتم استخدامتفاعل إسترية للحمض النيتري. في الإنتاج الفعلي، غالبًا ما يستخدم حمض السلفورك Concentrated (لديه سعر منخفض وسهولة التعامل). يمكن للحمض السلفورك Concentrated إنتاج كمية كبيرة من NO₂. مع عوامل ديهيدراتية أقوى مثل P₄O₁₀، يمكن أيضًا إنتاج كمية كبيرة من الكايشنات النترونية، وهو جوهرتفاعل النترATION. يتم استخدامتفاعل إسترية حمض النيتري أيضًا لإنتاج النتروك(cellulose)، و معادلةتفاعله هي: 3nHNO₃ + [C₆H₇O₂(OH)₃] n → [C₆H₇O₂(O – NO₂)₃] n + 3nH₂O.
(II)تفاعل النترATION
يمكن استخدام حمض النيتري Concentrated أو حمض النيتري الدخاني مع عوامل ديهيدراتية (حمض السلفورك Concentrated، pentoxide الفوسفور) كمتعامل نتراتي لبدءتفاعل النترATION لبعض المركبات. يعد هذاتفاعل تفاعل استبدال إلكتروفيلي، والجذب الإلكتروني هو أيون النترون. من الفायدة لعامل الديهيدراتية إنتاج أيون النترون. أكثرتفاعل النترATION شائعة هو نترATION البنزين، و معادلةتفاعله هي: Ph – H + HO – NO₂ → Ph – NO₂ + H₂O.
(III)تفاعل الأكسدة والاختزال
يقع العنصر النيتروجين في جزيء حمض النيتري في حالة القوة الأعلى (+5)، لذلك يمتلك حمض النيتري خصائص أكسدة قوية. يختلف منتجات الانخزال بتركيز حمض النيتري. بشكل عام، كلما ارتفع تركيز حمض النيتري، أقل عددًا من الإلكترونات يكتسب كل جزيء من حمض النيتري. يعد منتجات الانخزال للحمض النيتري Concentrated في الغالب دioxid النيتروجين، و منحلول حمض النيتري في الغالب هو oxido النيتروجين. يمكن إخزال حمض النيتري الم profond المزيد إلى oxido النيتروس، النيتروجين، أمونيوم النترات، وما إلى ذلك. مع ذلك، مع 진행تفاعل وتناقص تركيز حمض النيتري، قد يظهر جميع المنتجات المحتملة للانخزال. диγραما المحتملات ذات الصلة للحمض النيتري (في الشروط القياسية، E/V) هو ما يلي:
- HNO₃ – 0.798.9 → NO₂ – 1.08 → HNO₂ – 1.04 → NO – 1.582 → N₂O – 1.77 → N₂ – 0.27 → NH₄
- HNO₃ – 0.97 → NO
- HNO₃ – 1.25 → N₂O
- HNO₃ – 0.88 → N₂
(IV)تفاعلات نموذجية
التفاعلات التي تتضمن حمض النيتريك المركز
Zn + 4HNO₃ ==== Zn(NO₃)₂ + 2NO₂↑ + 2H₂O
ف + 5HNO₃ ==== H₃PO₄ + 5NO₂↑ + H₂O
التفاعلات التي تتضمن حمض النيتريك المخفف
3Zn + 8HNO₃ ==== 3Zn(NO₃)₂ + 2NO↑ + 4H₂O
3P + 5HNO₃ + 2H₂O ==== 3H₃PO₄ + 5NO↑
التفاعلات التي تنطوي على حمض النيتريك المخفف للغاية
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + N₂O↑ + 5H₂O
التفاعلات التي تنطوي على حمض النيتريك المخفف للغاية
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O
بالإضافة إلى ذلك، يمكن تأين حمض النيتريك النقي تلقائيًا: 2HNO₃ <==> H₂O + NO₂ + NO₃.
II. إجراءات حماية من التأثيرات السريرية للحمض النيتري
(I) المخاطر
يحتوي حمض النيتري على عدة أنواع من المخاطر. الم�ע مع بخار حمض النيتري يعد خطيرًا للغاية. الحمض النيتري في الصورة السائلة و بخاره ي ejer تأثيرًا قويًا على الجلد والغشا الم粘膜. يُشكل pentoxide النيتروجين المفر釋 من دخان حمض النيتري Concentrated غ foglًا حمضيًا عند tiếp الماء، والذي يمكن أن يتحلل بسرعة إلى dióxido النيتروجين. يمكن أيضًا تحلل بخار حمض النيتري Concentrated المعدي إلى dióxido النيتروجين. الاستنشاق يمكن أن يسبب zaturnación حادة للأوكسيدات النيتروجينية. عندما يكون التركيز أقل من 12 ppm (30 ملليجرام/م³)، لا يوجد إصابة واضحة بالبشر، والاستنشاق قد يسبب السرطان. LC50 للفئران التي يستنشقون حمض النيتري هو 49 ppm/4 ساعات. تظهر الحالات الأجنبية أن لثلاثة أشخاص استنشقوا دخان حمض النيتري، لم يكن هناك أعراض تنفسية في thời gian قصير. بعد 4 – 6 ساعات، حدث ضيق تنفس متقدم، وفي النهاية، ماتوا. يمكن أن يؤدي استنشاق دخان حمض النيتري إلى zaturnación حادة، ويمكن أن يسبب استنشاق حمض النيتري استوماتي�ي�س وتهاب معده، وربما يؤدي إلى صدمة أو فشل الكلى.
تشمل فئات المخاطر للحمض النيتري المواد المعدية الحمضية، الوحدات الأكسدة، ما قبل المتفاعلين الفائق للانفجار، المواد المعدية القوية (عندما يكون التكامل أعلى من 70%) / الوحدات الأكسدة (عندما لا يتجاوز التكامل 70%). وطرق الدخول هي الاستنشاق والاستنشاق. فيما يتعلق بأعراض السرطان، يمكن أن يستنشق غ fogl حمض النيتري يزعزع الجهاز التنفسي ويسبب от臾ف رئوي حاد؛ ويمكن أن يتسبب في آلام بطنية شديدة، وفي الحالات الشديدة، قد يحدث حفرات معده، التهاب البطن، وما إلى ذلك. يمكن أن يتسبب الم�ע المطول في تآكل الأسنان أيضًا. في الوقت نفسه، يكون حمض النيتري ضارًا بالبيئة، و هو مادة مساعدة للاحتراق. خلطه مع المواد الدافئة يمكن أن يسبب انفجارًا.
(II) إجراءات الإسعاف الاولي
م�ע الجلد: إزالة الملابس الملوثة على الفور وغس الجلد بكمية كبيرة من الماء المتدفق لمدة 20 – 30 دقيقة. التمويه للطبيب إذا كان هناك أي عدم الراحة.
م�ע العينين: رفع الجفان على الفور وغس العينين بكمية كبيرة من الماء المتدفق أو محلول فسيولوجي لمدة 10 – 15 دقيقة. التمويه للطبيب إذا كان هناك أي عدم الراحة.
استنشاق: انتقال بسرعة إلى منطقة بغداء نقي. حفاظ على وصول الهواء للجهاز التنفسي. إذا كان هناك صعوبة في التنفس، توفير الأوكسجين. إذا توقف التنفس وضرب القلب، إجراء احتياطات إرشاح القلب والتنفس على الفور وتمويه للطبيب في أقرب وقت ممكن.
استنشاق: غس嘴巴 بالwasser، شرب الحليب أو بيض البيضة، ثم التمويه للطبيب.
(III) إجراءات طارئة في حالة تسرب
تحديد منطقة التحذير وفقاً لمنطقة التأثير للنزع السائل وانتشار البخار، وتخلع الأفراد غير المتعلقين من الاتجاهات الخلفية والمتع吹拂ة إلى منطقة آمنة.
من المستحيل أن يعمل موظفو الإسعاف الاولي يرتدوا جهاز التنفس الذاتي带有الضغط المثبت وملابس مقاومة للحمض. يجب أن يكون كل الجهاز المستخدم أثناء العمل موضعيًا. لا تلمس الحاوية المقطعة والمادة المفرصة دون ارتداء ملابس حماية مناسبة.
قطع مصدر التسرب بأكمله ما استطاع. منع دخول المادة المفرصة إلى الأجسام المائية، المجاري الصرفية، السوابق أو الفضاءات المغلقة.
رش غ fogl الماء للكشف عن البخار أو تغيير اتجاه سحابة البخار، و avoidance مواجهة الماء مع المادة المفرصة. لا تسمح بالدخول الماء إلى الحاوية التغليفية.
في حالة تسرب صغير: تغطية المادة المفرصة ب saud خôن أو مواد غير قابلة للاشتعال الأخرى.
في حالة تسرب كبير: بناء جدران أو حفر حجارة للاستلام. امتصاص كمية كبيرة من السائل بغبار الرماد أو طليعة الرماد. تحميل مع agricultural طليعة (CaO)، حجارة الكالسيوم الكربوناتية المفرومة (CaCO₃)، أو bi 碳酸盐 الصوديوم (NaHCO₃). تغطية بغنوم antisolvent للحد من التبخر. نقل إلى ناقلة خزان أو جمعي خاص ببوم مقاوم للاستهلاك.编辑分享