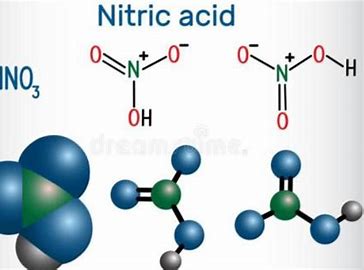
Азотная кислота/7697-37-2/HNO3
I. Физические свойства азотной кислоты
Азотная кислота имеет яркие физические характеристики в разных состояниях. Чистая азотная кислота представляет собой бесцветную прозрачную жидкость, а концентрированная азотная кислота имеет желтоватый оттенок из-за растворенного диоксида азота. В обычных условиях это бесцветная прозрачная жидкость с дыхательным раздражающим запахом.
Содержание азотной кислоты в концентрированной азотной кислоте составляет около 68%. Эта концентрация делает ее leichtос парной.
Азотная кислота, испаряющаяся в воздухе (обычно диоксид азота, разлагающийся из концентрированной азотной кислоты), kombiniert с паром воды и формирует белый дым, что аналогично явлению у концентрированной хлорной кислоты. Азотная кислота смешивается с водой и также может formar азеотропную смесь с водой.
С учетом конкретных физических параметров, относительная плотность ангидроно азотной кислоты (относительно воды = 1) составляет 1,50, температура плавления составляет -42°C, а температура кипения – 83°C. Ее относительная плотность пара (относительно воздуха = 1) находится в диапазоне от 2 до 3, насыщенное паровое давление при 20°C составляет 6,4 кПа, критическое давление – 6,89 МПа, коэффициент распределения октанол/вода составляет 0,21. По.solимости азотная кислота не только смешивается с водой, но и растворяется в диэтиле. При 20°C вязкость азотной кислоты составляет 0,89 мПа・с. Также теплоемкость азотной кислоты разной концентрации также различна. Теплоемкость азотной кислоты концентрацией 98,15% составляет 1,99 кДж/(кг・К), 90,33% – 2,22 кДж/(кг・К), 70,00% – 2,56 кДж/(kg・K), 40,00% – 2,80 кДж/(кг・К). Кроме того, электропроводность азотной кислоты разной концентрации имеет значительные различия. электропроводность азотной кислоты концентрацией 30,42% составляет高达 7008 С/м, а электропроводность азотной кислоты концентрацией 98,50% составляет только 167,8 С/м.
II. Химические свойства азотной кислоты
(I) Нестабильность
Химические свойства концентрированной азотной кислоты нестабильны. При попадании на свет или нагреве она проходит разложительную реакцию, освобождая диоксид азота. Диоксид азота, образующийся в ходе разложения, растворяется в азотной кислоте, что делает внешний вид азотной кислоты желтоватым. В сравнении с этим разбавленная азотная кислота имеет большую стабильность. азотная кислота с концентрацией от 70% до 90% не разлагается при 0°C в темноте.
(II) Сильная кислотность
В водном растворе азотная кислота полностью ионизируется, образуя большое количество ионов водорода. Как гидрат азота в максимальной валентности (+5), азотная кислота имеет сильную кислотность.
(III) Эстерификация
Азотная кислота может вступать в реакцию эстерификации с спиртами, следуя механизму “кислота отбрасывает гидроксильную группу, а спирт отбрасывает водород”, который аналогичен принципу реакции эстерификации карбоновых кислот. Эта характеристика используется для производства нитроклетчатки. Чrez 特定ную химическую реакцию азотная кислота реагирует с целлюлозой, образуя нитроклетчатку и воду.
(IV) Нитрирование
Когда концентрированная азотная кислота или дымящаяся азотная кислота смешиваются с дегидратирующими агентами (например, koncentрированная серная кислота, пентаоксид фосфора), они могут использоваться в качестве нитрирующих реагентов для инициирования нитрирования некоторых соединений. Эта реакция относится к электрофильному замещению. Электрофильный реагент в ней представляет собой ион нитрония. Наличие дегидратирующих агентов способствует образованию иона нитрония. Нитрирование бензола является обычным примером реакции нитрирования.

(V) Окислительная способность
Азотный элемент в молекуле азотной кислоты находится в максимальной валентности (+5), что придает азотной кислоте сильную окислительную способность. .productы ее восстановления могут изменяться в зависимости от концентрации азотной кислоты. В целом чем выше концентрация азотной кислоты, тем сильнее ее окислительная способность. В реакции среднее количество электронов, необходимых для каждой молекулы азотной кислоты, меньше, а оксидационный статус восстановительного продукта выше. Например, в реакции концентрированная азотная кислота образует диоксид азота, а разбавленная азотная кислота образует оксид азота. Также азотная кислота может сделать wollenые ткани и животные органы желтоватыми, может окислить элементарный сер и фосфор, образуя серную и фосфорную кислоты, и может растворять различные металлы, образуя растворы азотатов. Однако металлы, такие как железо, хром, алюминий, попадают в пассивное состояние в концентрированной азотной кислоте, а в разбавленной азотной кислоте они могут растворяться; металлы, такие как олово, антимон, молибден, образуют нерастворимые оксиды при реакции с азотной кислотой. Из-за сильной окислительной способности азотной кислотыводород нельзя получать с ее помощью, и азотная кислота может окислить ионы йода в йодwasserном растворе на элементарный йод или ион йодата. Кроме того, азотная кислота имеет горючее-supporting property и представляет риск взрыва при смешивании с горючими веществами.