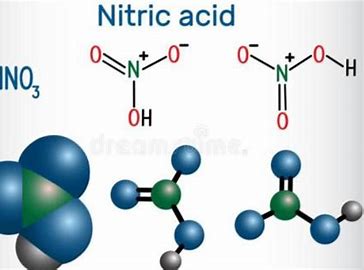
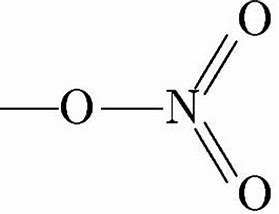
Азотная кислота/7697-37-2/HNO3
Нитратная кислота, как важное химическое вещество, широко используется в различных областях. Ниже будут детально рассмотрены ее химические реакции, токсикологические меры безопасности и другие аспекты.
I. Химические реакции нитратной кислоты
(I) Этерификация
Нитратная кислота может вступать в реакцию этерификации с спиртом с образованием соответствующего нитрата. С точки зрения механизма в прошлом было полагано, что реакция этерификации с участием нитратной кислоты приводит к образованию карбокатионного интерmedia. Однако в настоящее время многие литературные источники описывают ее механизм как реакцию фишера этерификации, то есть «кислота теряет гидроксильную группу, а спирт – водород», что совпадает с механизмом этерификации карбоновых кислот. Например, при получении нитроглицерина используется реакция этерификации нитратной кислоты. В производстве обычно используют концентрацию серной кислоты ( низкая стоимость и простота обращения). Концентрация серной кислоты может hervorождать значительное количество NO₂. С другими более сильными дегидратирующими агентами, такими как P₄O₁₀, также может быть сформировано значительное количество нитроновых катионов, что является сущностью нитрирования. Реакция этерификации нитратной кислоты также используется для производства нитроклетчатки. Уравнение реакции выглядит следующим образом: 3nHNO₃ + [C₆H₇O₂(OH)₃]n → [C₆H₇O₂(O – NO₂)₃]n + 3nH₂O.
(II) Нитрирование
Концентрированная нитратная кислота или дымящаяся нитратная кислота, смешанные с дегидратирующими агентами (концентрированная серная кислота, пентаоксид фосфора), могут использоваться в качестве нитрирующего реагента для инициации реакции нитрирования некоторых соединений. Эта реакция относится к электрофильной подстановке, и электрофилом является нитроновый катион. Дегидратирующий агент способствует образованию нитронового катиона. Наиболее распространенной реакцией нитрирования является нитрирование бензола. Уравнение реакции выглядит следующим образом: Ph – H + HO – NO₂ → Ph – NO₂ + H₂O.
(III) Окислительно-восстановительная реакция
Азот в молекуле нитратной кислоты находится в наивысшей валентной степени (+5), поэтому нитратная кислота имеет сильную окислительную способность. Ее восстановительные продукты варьируются в зависимости от концентрации нитратной кислоты. В целом, чем выше концентрация нитратной кислоты, тем меньше электронов получает каждая молекула нитратной кислоты. Восстановительные продукты koncentрированной нитратной кислоты в основном представляют собой диоксид азота, а разбавленной нитратной кислоты – оксид азота. В более разбавленной нитратной кислоте могут быть восстановлены оксид дinitrogenа, азот, аммонийный нитрат и другие продукты. Однако по ходу реакции концентрация нитратной кислоты понижается, и все возможные восстановительные продукты могут появиться. Схема потенциалов нитратной кислоты (при стандартных условиях, E/V) выглядит следующим образом:
- HNO₃ – 0,798,9 → NO₂ – 1,08 → HNO₂ – 1,04 → NO – 1,582 → N₂O – 1,77 → N₂ – 0,27 → NH₄
- HNO₃ – 0,97 → NO
- HNO₃ – 1,25 → N₂O
- HNO₃ – 0,88 → N₂

(IV) Типичные реакции
- Реакции с участием koncentрированной нитратной кислоты
- Zn + 4HNO₃ ==== Zn(NO₃)₂ + 2NO₂↑ + 2H₂O
- P + 5HNO₃ ==== H₃PO₄ + 5NO₂↑ + H₂O
- Реакции с участием разбавленной нитратной кислоты
- 3Zn + 8HNO₃ ==== 3Zn(NO₃)₂ + 2NO↑ + 4H₂O
- 3P + 5HNO₃ + 2H₂O ==== 3H₃PO₄ + 5NO↑
- Реакции с участием очень разбавленной нитратной кислоты
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + N₂O↑ + 5H₂O - Реакции с участием крайне разбавленной нитратной кислоты
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O
Кроме того, чистая нитратная кислота может_autoионизироваться: 2HNO₃ <==> H₂O + NO₂ + NO₃.
II. Токсикологические меры безопасности для нитратной кислоты
(I) Опасность
Нитратная кислота имеет несколько типов опасностей. Контакт с парами нитратной кислоты представляет значительную опасность. Нитратная кислота в жидком виде и ее пары имеют сильное раздражающее и корродирующее действие на кожу и слизистые оболочки. Пентаоксид азота, выделяющийся при дымлении koncentрированной нитратной кислоты, при контакте с парами воды формирует кислотный дым, который может быстро расщепляться на диоксид азота. Пары нитратной кислоты, образующиеся при нагревании koncentрированной нитратной кислоты, также могут расщепляться на диоксид азота. Вдыхание может привести к острым отравлениям оксидами азота. При концентрации ниже 12 ppm (30 мг/м³) на человека не имеет явных повреждений, а вдыхание может привести к пневмонии. LC50 для крыс при вдыхании нитратной кислоты составляет 49 ppm/4 часа. Имеются случаи, когда у трех человек, вдышавших дымы нитратной кислоты, в кратчайшие сроки не было отчетных респираторных симптомов. Через 4 – 6 часов развивается прогрессирующее затрудненное дыхание, в конечном счете они погибли. Вдыхание дымов нитратной кислоты может привести к острым отравлениям. П ри поедании нитратной кислоты может возникнуть коррозивный stomatит и гастроэнтерит, а также могут возникнуть шок или отек почек.
Ее категории опасности включают кислые корродирующие вещества, окислительные агенты, взрывоопасные вещества, сильные корродирующие вещества (если содержание выше 70%) / окислительные агенты (если содержание не превышает 70%). Путь проникновения – вдыхание, поедание. Весли речь идет о вреде для здоровья, вдыхание туманов нитратной кислоты может вызвать раздражение дыхательных путей и острый отек легких; поедание может привести к сильной боли в животе, а в тяжелых случаях – к перфорации желудка, перитоните и другим проблемам; контакт с глазами и кожей может привести к ожогам. Пrolонгированное контакт может также привести к эрозии зубов. В то же время нитратная кислота вредна для окружающей среды, и она способствует горению. Смешивание с горючими веществами может привести к взрыву.
(II) Срочные меры по оказанию первой помощи
- Контакт с кожей: Сразу снять загрязненную одежду и промыть кожу बडшим количеством текучей воды в течение 20 – 30 минут. При наличии неудобств обратиться к врачу.
- Контакт с глазами: Сразу поднять век и промыть глаза большим количеством текучей воды или физиологическим раствором в течение 10 – 15 минут. При наличии неудобств обратиться к врачу.
- Вдыхание: Срочно перевести на воздух с чистойвоздухом. Сдерживать проходимость дыхательных путей. При затрудненном дыхании обеспечить подачу кислорода. При остановке дыхания и сердцебиения сразу выполнятькардиопульмональную реанимацию и как можно скорее обратиться к врачу.
- Поедание: Промыть рот водой, пить молоко илибелок яиц, а затем обратиться к врачу.
(III) Срочные меры по ликвидации утечки
- Определить зону предостережения в зависимости от зоны влияния течения жидкости и рассеяния паров, а несущественные лица эвакуировать с ливового и восходящего ветра в безопасную зону.
- Рекомендуется эвакуационным сотрудникам носить положительно давление самообеспечивающую дыхание_MASKу и кислотоустойчивую одежду. Все оборудование, используемое во время операции, должно быть заземлено. Нельзя контактировать с разбитым контейнером и утекающими веществами без надевания соответствующейзащитной одежды.
- Как можно скорее заблокировать источник утечки. Предотвратить проникновение утекающих веществ в водные тела, сточные системы, подвалы или за密封рованные пространства.
- Пылесосить воду для подавления паров или изменения направления пара, избегать контакта течения воды с утекающими веществами. Нельзя позволить воде попасть в упаковочный контейнер.
- При малой утечке: покрыть утекающее вещество сухим песком или другими непожарными материалами.
- При крупной утечке: построить дамбу или расчистить яму для захвата утекающего вещества. Абсорбировать большое количество жидкости пылью или пеплом из известкового вahu. Нейтральный化ить с использованиемагропепла (CaO), измельченного известкового вahu (CaCO₃) или соды на트рия (NaHCO₃). Покрыть антирастворимым пенообразующим веществом для уменьшения испарения. Перемещать с использованием коррозионноустойчивого насоса в цистерну или специальный сборник.