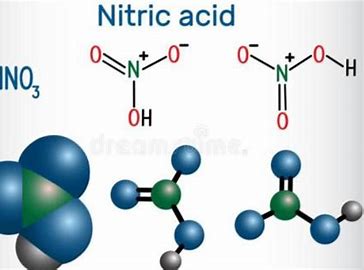
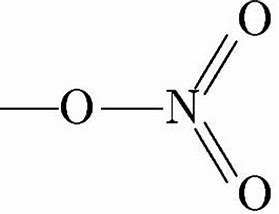
Ácido nítrico/7697-37-2/HNO3
El ácido nítrico, como una sustancia química importante, se utiliza ampliamente en diversos campos. A continuación, se presentará una descripción detallada de sus reacciones químicas, prevención toxicológica y otros aspectos.
I. Reacciones Químicas del Ácido Nítrico
(I) Reacción de Esterificación
El ácido nítrico puede sufrir una reacción de esterificación con el alcohol para formar el correspondiente nitrato. En cuanto al mecanismo, en el pasado, se creía que la reacción de esterificación que implica el ácido nítrico generaba un intermediario de carbocatión. Sin embargo, actualmente, muchos documentos describen su mecanismo como la reacción de esterificación de Fischer, es decir, “el ácido pierde un grupo hidroxilo y el alcohol pierde un átomo de hidrógeno”, lo cual es igual al mecanismo de esterificación de los ácidos carboxílicos. Por ejemplo, en la preparación de nitroglicerina, se utiliza la reacción de esterificación del ácido nítrico. En la producción real, se suele utilizar ácido sulfúrico concentrado (tiene un costo bajo y es fácil de manejar). El ácido sulfúrico concentrado puede producir una gran cantidad de NO₂. Con otros agentes deshidratantes más fuertes, como P₄O₁₀, también se puede producir una gran cantidad de cationes nitronio, lo cual es la esencia de la reacción de nitración. La reacción de esterificación del ácido nítrico también se utiliza para producir nitrocelulosa, y su ecuación de reacción es: 3nHNO₃ + [C₆H₇O₂(OH)₃]n → [C₆H₇O₂(O – NO₂)₃]n + 3nH₂O.
(II) Reacción de Nitración
El ácido nítrico concentrado o el ácido nítrico humeante mezclado con agentes deshidratantes (ácido sulfúrico concentrado, pentóxido de fósforo) se puede utilizar como un reactivo de nitración para iniciar la reacción de nitración de algunos compuestos. Esta reacción es un tipo de reacción de sustitución electrofílica, y el electrofilo es el ion nitronio. El agente deshidratante es beneficioso para la generación del ion nitronio. La reacción de nitración más común es la nitración del benceno, y su ecuación de reacción es: Ph – H + HO – NO₂ → Ph – NO₂ + H₂O.
(III) Reacción de Oxido-Reducción
El elemento nitrógeno en la molécula de ácido nítrico está en el estado de valencia más alto (+5), por lo que el ácido nítrico tiene propiedades oxidantes fuertes. Sus productos de reducción varían dependiendo de la concentración de ácido nítrico. En general, cuanto mayor es la concentración de ácido nítrico, menos electrones gana en promedio cada molécula de ácido nítrico. Los productos de reducción del ácido nítrico concentrado son principalmente dióxido de nitrógeno, y los del ácido nítrico diluido son principalmente óxido de nitrógeno. El ácido nítrico más diluido puede ser reducido a óxido nitroso, nitrógeno, nitrato de amonio, etc. Sin embargo, a medida que la reacción continúa y la concentración de ácido nítrico disminuye, pueden aparecer todos los posibles productos de reducción. El diagrama de potenciales relevantes del ácido nítrico (en condiciones estándar, E/V) es el siguiente:

- HNO₃ – 0.798.9 → NO₂ – 1.08 → HNO₂ – 1.04 → NO – 1.582 → N₂O – 1.77 → N₂ – 0.27 → NH₄
- HNO₃ – 0.97 → NO
- HNO₃ – 1.25 → N₂O
- HNO₃ – 0.88 → N₂
(IV) Reacciones Típicas
- Reacciones con Ácido Nítrico Concentrado
- Zn + 4HNO₃ ==== Zn(NO₃)₂ + 2NO₂↑ + 2H₂O
- P + 5HNO₃ ==== H₃PO₄ + 5NO₂↑ + H₂O
- Reacciones con Ácido Nítrico Diluido
- 3Zn + 8HNO₃ ==== 3Zn(NO₃)₂ + 2NO↑ + 4H₂O
- 3P + 5HNO₃ + 2H₂O ==== 3H₃PO₄ + 5NO↑
- Reacciones con Ácido Nítrico Muy Diluido
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + N₂O↑ + 5H₂O - Reacciones con Ácido Nítrico Extremadamente Diluido
4Zn + 10HNO₃ ==== 4Zn(NO₃)₂ + NH₄NO₃ + 3H₂O
Además, el ácido nítrico puro puede sufrir autoionización: 2HNO₃ <==> H₂O + NO₂ + NO₃.
II. Prevención Toxicológica del Ácido Nítrico
(I) Peligros
El ácido nítrico tiene múltiples peligros. El contacto con el vapor de ácido nítrico es muy peligroso. El líquido de ácido nítrico y su vapor tienen un fuerte efecto irritante y corrosivo en la piel y las membranas mucosas. El pentóxido de nitrógeno liberado por los humos del ácido nítrico concentrado forma una neblina ácida cuando entra en contacto con el vapor de agua, la cual puede descomponerse rápidamente en dióxido de nitrógeno. El vapor de ácido nítrico generado por el ácido nítrico concentrado al calentar también se puede descomponer en dióxido de nitrógeno, y la inhalación puede causar intoxicación aguda por óxidos de nitrógeno. Cuando la concentración es inferior a 12 ppm (30 mg/m³), no hay daño evidente en los seres humanos, y la inhalación puede causar neumonía. La LC50 para las ratas que inhalan ácido nítrico es de 49 ppm/4 horas. Casos extranjeros muestran que en tres personas que inhalaron humos de ácido nítrico, en un corto plazo no hubo síntomas respiratorios. Después de 4 – 6 horas, se produjo disnea progresiva y, finalmente, fallecieron. La inhalación de humos de ácido nítrico puede causar intoxicación aguda, y la ingesta oral de ácido nítrico puede causar estomatitis y gastroenteritis corrosivos, e incluso puede causar shock o insuficiencia renal.
Sus categorías de peligro incluyen sustancias corrosivas ácidas, agentes oxidantes, precursores explosivos, sustancias corrosivas fuertes (cuando el contenido es mayor del 70%) / agentes oxidantes (cuando el contenido no excede el 70%). Las rutas de entrada son la inhalación y la ingesta. En términos de riesgos para la salud, la inhalación de neblina de ácido nítrico irritará los tractos respiratorios y causará edema pulmonar agudo; la ingesta oral causará dolor abdominal severo y, en casos graves, pueden ocurrir perforación gástrica, peritonitis, etc.; el contacto con los ojos y la piel causará quemaduras. El contacto prolongado también puede causar erosión dental. Al mismo tiempo, el ácido nítrico es dañino para el medio ambiente y es una sustancia combustible. Mezclarlo con combustibles causará una explosión.
(II) Medidas de Primeros Auxilios
- Contacto con la Piel: Retirar inmediatamente la ropa contaminada y lavar profundamente con una gran cantidad de agua corriente durante 20 – 30 minutos. Buscar atención médica si hay algún tipo de incomodidad.
- Contacto con los Ojos: Levantar inmediatamente las pestañas y lavar profundamente con una gran cantidad de agua corriente o solución fisiológica durante 10 – 15 minutos. Buscar atención médica si hay algún tipo de incomodidad.
- Inhalación: Mover rápidamente a una zona con aire fresco. Mantener la vía respiratoria despejada. Si hay dificultad para respirar, suministrar oxígeno. Si la respiración y el latido del corazón se detienen, realizar inmediatamente la resucitación cardiopulmonar y buscar atención médica lo más pronto posible.
- Ingesta: Enjuagar la boca con agua, beber leche o clara de huevo y luego buscar atención médica.
(III) Medidas de Emergencia en caso de Fuga
- Designar un área de advertencia de acuerdo con el área de influencia del flujo de líquido y la difusión de vapor, y evacuar a las personas no relacionadas desde las direcciones del viento hacia atrás y del viento hacia arriba a una zona segura.
- Se recomienda que el personal de tratamiento de emergencias use un aparato de respiración autónomo a presión positiva y ropa resistente al ácido. Todo el equipo usado durante la operación debe estar puesta a tierra. No tocar el envase roto y la sustancia derramada sin llevar la ropa de protección adecuada.
- Cortar el origen de la fuga tanto como sea posible. Prevenir que la sustancia derramada entre en cuerpos de agua, cloacas, sótanos o espacios cerrados.
- Aspersar neblina de agua para suprimir el vapor o cambiar la dirección del cúmulo de vapor, y evitar el contacto entre el flujo de agua y la sustancia derramada. No permitir que el agua entre en el envase de empaque.
- En caso de fugas pequeñas: Cubrir la sustancia derramada con arena seca u otros materiales no inflamables.
- En caso de fugas grandes: Construir diques o excavar hoyos para contención. Absorber una gran cantidad de líquido con ceniza volante o cal powder. Neutralizar con cal agrícola (CaO), caliza triturada (CaCO₃) o bicarbonato de sodio (NaHCO₃). Cubrir con espuma antisolvente para reducir la evaporación. Transferir a un camión cisterna o un colector especial con una bomba resistente a la corrosión.