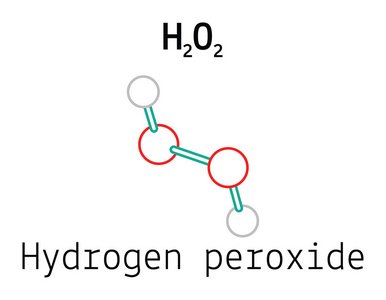
Перекись водорода(7722-84-1)H2O2
Перексид водорода представляет собой бесцветный жидкость с leichtой раздражающей запахом и является прозрачным при нормальных температурах и давлении. Чистый перекис водорода представляет собой светло-синий вязкий жидкость. Перекис водорода имеет уникальные физические параметры, которые приведены ниже:
| Номер по порядку | Физические свойства | Единица | Значение |
|---|---|---|---|
| 01 | Точка плавления | ℃ | -0.425 |
| 02 | Точка кипения | ℃ | 150.1 |
| 03 | Плотность | g/cm³ | 1.441 |
| 04 | Критическая температура | ℃ | 457 |
| 05 | Критический коэффициент сжатия | — | 0.358 |
| 06 | Дипольный момент | D | 2.26 |
| 07 | Стандартная молярная энтальпия сгорания | kJ/mol | -53.7 |
| 08 | Молярная теплота парообразования | kJ/mol | -46.674 |
| 09 | Стандартная молярная Гиббсова свободная энергия образования | kJ/mol | -120.35 |
| 10 | Стандартная молярная энтальпия образования | kJ/mol | -187.78 |
| 11 | Стандартная молярная энтропия | kJ×kmol⁻¹×K⁻¹ | 109.6 |
| 12 | Стандартная API-сильность | ° | -33.6697 |
| 13 | Молярная масса | kg/kmol | 34.0147 |
Перексид водорода следует принципу “подобное растворяется в подобном”. Он растворяется в полярных веществах, таких как спирты и эфиры, но не растворяется в неполярных веществах, таких как бензол и петролевые эфиры. Кроме того, перекис водорода miscible с водой в любом соотношении для образования раствора перекиси водорода, обычно называемого перекисью водорода. Общие коммерчески доступные концентрации составляют 30% и 3% по массе. Кроме того, точки плавления и кипения чистых молекул перекиси водорода изменяются с изменением ее конфигурации. Благодаря большей степени ассоциации по сравнению с водой, у него есть более высокий диэлектрический constante и температура кипения.
Химические свойства перекиси водорода
Молекула перекиси водорода содержит перекисьевую связь (-O-O-), с атомом водорода, связанным с каждой концом. атом водорода и атом кислорода находятся в разных плоскостях, и угол между двумя плоскостями составляет 115°. Угол между перекисьевой связью (красный) и водородно-кислородной связью (зеленый) составляет 94.8°, а длины связей составляют 147.5 нм и 95 нм соответственно.
Нестабильность
Перексид водорода наиболее стабилен в слабокислой среде (с pH между 3.5 и 4.5). Он крайне восприимчив к разложению в щелочной среде и также разлагается при попадании в сильный свет, особенно в кратковолновой радиации. Перекис водорода образует взрывоопасные смеси с многими органическими веществами, такими как сахара, крахмал, спирты и продукты нефти. Он может взрываться при поражении, нагреве или электрических искрах. Хотя сам перекис водорода не горючий, он может реагировать с горючими веществами, выделяя большое количество тепла и кислорода, что может привести к возгоранию и взрыву. H₂O₂ крайне восприимчив к разложению на кислород и воду в условиях, таких какосвещение, нагрев (разложение идет медленно при комнатной температуре, а выше 153 °C оно может быстро разлагаться с взрывом), присутствие некоторых металлических солей (например, хлорид железа FeCl₃), металлических оксидов (диоксид марганца MnO₂) или шероховатой активной поверхности. Контакт с многими неорганическими соединениями или примесями может привести к быстрому разложению и взрыву, выделяя большое количество тепла, кислорода и пара воды. Большинство тяжелых металлов (например, железа, меди, серебра, свинца, ртути, цинка, кобальта, никеля, хрома, марганца и т.д.) и их оксидов и солей являются активными катализаторами, а вещества, такие как пыль, пепел сигарет, углеродный пудра и ржавчина, также могут ускорять разложение. Для ингибирования разложения перекиси водорода, с одной стороны, стеклянные контейнеры для хранения перекиси водорода в основном коричневого цвета. С другой стороны, добавление некоторых стабилизаторов, таких как следовые количества станната натрия (Na₂SnO₃) и пирофосфата натрия (Na₄P₂O₇).
Сильная окислительная способность
В кислой среде (обычно окисляется серной кислотой H₂SO₄ и хлорной кислотой HCl) окислительная способность перекиси водорода более ausgeчеркнута, чем в щелочной среде, и она может действовать как сильный окислитель. Кислород в перекисьевой связи получает электроны и восстанавливается до более стабильного кислорода с валентностью -2 (H₂O). Вот некоторые примеры действия перекиси водорода как сильного окислителя:
H₂O₂ + 2I⁻ + 2H⁺ → I₂ + 2H₂O
H₂O₂ + 2Fe²⁺ + 2H⁺ → 2Fe³⁺ + 2H₂O
4H₂O₂ + PbS → PbSO₄ + 4H₂O
Между тем, серيد свинца имеет черный цвет, асульфат свинца имеет белый цвет. Поэтому, H₂O₂ может быть использован для чистки масляных obrazов, старой мебели и белье бумаги.
Слабая восстанавливающая способность
Окислительное состояние кислорода в перекисьевой связи составляет -1, которое находится между -2 (наименьшее) и 0 (наибольшее). Поэтому, перекис водорода проявляет восстанавливающие свойства (окисляется до O₂) при контакте с более сильными окислителями в определенных условиях. Взять, например, перманганат калия (KMnO₄) и хлор (Cl₂):
2KMnO₄ + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + K₂SO₄ + 5O₂↑ + 8H₂O
H₂O₂ + Cl₂ → 2HCl + O₂
Слабая кислотность
Перексид водорода является двуосновной слабой кислотой и диссоцируется в водном растворе в двух этапах. Его первый константа диссоциации относительно мала (pKa1 = 11.64), а второй константа диссоциации еще меньше (pKa2 = 25). Он может undergo кисло-щелочные нейтрализационные реакции с сильными основаниями. Взять, например, гидроксид натрия (NaOH):
H₂O₂ ⇌ H⁺ + HO₂⁻ Ka1 = 2.3×10⁻¹²
HO₂⁻ ⇌ H⁺ + O₂⁻ Ka2 = 10⁻²⁵
H₂O₂ + 2NaOH → Na₂O₂ + 2H₂O
Поэтому, пероксид натрия (Na₂O₂) может быть рассмотрен как соль перекиси водорода в определенной степени.
Токсикологические данные перекиси водорода
Токсикологические данные перекиси водорода следующие:
LD50 составляет 2000 rag/kg (п经口 введение мышам).
GRAS (Food and Drug Administration, §184.1366, 2000).
Приемлемый ежедневный прием (ADI) не указан (используется только в том случае, если нет лучшего способа хранения молока; Food and Agriculture Organization/World Health Organization, 2001).
Частое контактирование с перекисью водорода может привести к дерматиту, бронхальным и легким заболеваниям. При отравлении приема経口 могут出現 такие симптомы, как боль в животе, боль в груди, дыхательная затрудненность, рвота, повышение температуры тела, кровотечение конъюнктивы и кожи. В некоторых случаях могут出現 визуальные поражения, судороги и параляз. В Соединенных Штатах обычно указана максимальная допустимая концентрация 1.4 mg/m³.
China and chemical raw material suppliers, welcome to inquire,Contact us:https://www.yuhanchemi.com/contact