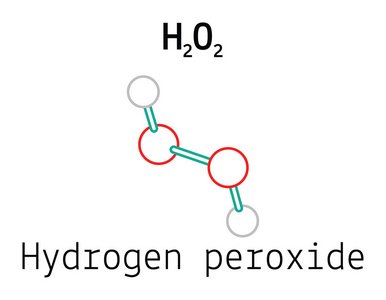
بيروكسيد الهيدروجين(7722-841)H2O2
يظهر过氧化氢 ك Liquid عديم اللون ويتضمن رائحة م剌ية رفيعة ويعتبر trong الضغط ودرجة الحرارة العاديةtransparent. 而过氧化氢 الشحيح هو Liquid لزجوي لون الأزرق الأبيض. 而过氧化氢 يحتوي على معلمات خصائص فيزيائية فريدة، على النحو التالي:
| Serial Number | الخصائص الفيزيائية | الوحدة | القيمة |
|---|---|---|---|
| 01 | درجة الذوبان | ℃ | -0.425 |
| 02 | درجة الغراء | ℃ | 150.1 |
| 03 | الكثافة | g/cm³ | 1.441 |
| 04 | درجة الحرارة الش critical | ℃ | 457 |
| 05 | عامل الضغط الش critical | — | 0.358 |
| 06 | معدل偶 dipole | D | 2.26 |
| 07 | combustion المولار المعياري Enthalpy | kJ/mol | -53.7 |
| 08 | combustion المولار Heat | kJ/mol | -46.674 |
| 09 | Standard Molar Gibbs Free Energy of Formation | kJ/mol | -120.35 |
| 10 | enthalpy المعياري المولار للFORMATION | kJ/mol | -187.78 |
| 11 | 墒 المولار المعياري | kJ×kmol⁻¹×K⁻¹ | 109.6 |
| 12 | الكثافة API المعياري | ° | -33.6697 |
| 13 | الكتلة المولارية | kg/kmol | 34.0147 |
يتابع过氧化氢 مبدأ “مصمم يذوب في مشابه”. فهو يذوب في المواد полارية مثل ال Alcohol وethers، ولكن لا يذوب في المواد غير полارية مثل البنزين وethers النفطية. إضافة إلى ذلك، يمكن أن يذوب过氧化氢 مع الماء بنسب مختلفة لFORMATION محلول过氧化氢، المعروف باسم محلول过氧化氢. وتشمل التركيزات الشائعة في السوق 30% و 3% بالكتلة. علاوة على ذلك، تتغير درجات الذوبان والغراء لجزيئات过氧化氢 الشحيح مع تغيير تنظيمها. نظرًا لدرجة ارتباطها الأكبر بالماء، فهو يحتوي على ثابت إلكتريكي ودرجة غراء أعلى.
خصائص كيميائية过氧化氢
يحتوي جزيء过氧化氢 على رابطة peroxide (-O-O-)، مع وجود ذرة هيدروجين متصلة بكل نهاية. وتكون الذرة الهيدروجين وال أكسجين في مستويات مختلفة، ويعتبر زاوية ما بين المستويين 115°. و زاوية ما بين رابطة peroxide (الأحمر) و رابطة هيدروجين- أكسجين (الأخضر) 94.8°، وطول الرابطة分别 147.5 nm و 95 nm.
عدم الثبات
يكون过氧化氢 أكثر استقرار في بيئة حمضية ضعيفة (مع pH ما بين 3.5 و 4.5). فهو معرض للتفكك بدرجة كبيرة في محلول قوي، ويفكك أيضًا عندما يتعرض للضوء القوي، وخاصة الإشعاعات الم短波. ويتشكل مع العديد من المواد العضوية مثل السكر والشר�淀粉 وال Alcohol والمنتجات النفطية، مزيجًا متفجرًا. ويمكن أن يفجر عندما يتعرض للضربة أو الحرارة أو النزلات الكهربائية. على الرغم من أن过氧化氢 bảnhu غير مت inflammable، إلا أنه يمكن أن يتفاعل مع المواد المflammable، ويطلق كمية كبيرة من الحرارة وال أكسجين، مما قد يسبب الإ ignition و الفجوة. ويعتبر H₂O₂ معرضًا بدرجة كبيرة للتفكك إلى الأكسجين والماء في ظروف مثل إرشاد الضوء أو التدفئة (يكون التفكك بطيئًا في درجة الحرارة room، ويمكن أن يفكك بسرعة ويتسبب في الفجوة khi تتجاوز درجة الحرارة 153 درجة Цيلسيوس). ويمكن أن يفكك بسرعة وتسبب الفجوة في حالة tiếp촉 مع العديد من المركبات الكيميائية غير العضوية أو الملوحات، ويطلق كمية كبيرة من الحرارة والأكسجين والماء蒸气. ويعتبر معظم المعادن الثقيلة (مثل الحديد والكبرتة والفضة والرصاص والزنجبيل والنحاس والكوبلت والنيكل والكروم والمغنيس وما إلى ذلك) وأوكسيداتها وملاحها من الم触媒 النشطة، ويمكن أن يسرع النζارة ورماد السिगارة وغبار الكربون ورماد الحديد التفكك. لاستئناف تفكك过氧化氢، على النحو التالي، فإن حجارة تخزين محلول过氧化氢 غالبًا من لون البنفسج. ومن ناحية أخرى، إضافة بعض الم触媒 مثل كميات صغيرة من sodium stannate (Na₂SnO₃) و sodium pyrophosphate (Na₄P₂O₇).
خاصية أكسدة قوية
في بيئة حمضية (بشكل عادي مع إخضارها ب sulfuric acid H₂SO₄ و hydrochloric acid HCl)، يظهر过氧化氢 خاصية أكسده بشكل أكثر براعة من في بيئة قوية، ويمكن أن يعمل كعامل أكسدة قوي. ويتنقص أكسجين في رابطة peroxide الإلكترونات ويتحول إلى أكسجين أكثر استقرار بمرتبة -2 (H₂O). فيما يلي بعض الأمثلة على过氧化氢 كعامل أكسدة قوي:
H₂O₂ + 2I⁻ + 2H⁺ → I₂ + 2H₂O
H₂O₂ + 2Fe²⁺ + 2H⁺ → 2Fe³⁺ + 2H₂O
4H₂O₂ + PbS → PbSO₄ + 4H₂O
وخلالها، PbS سوداء، و PbSO₄ أبيض. لذلك، يمكن استخدام H₂O₂ لتنظيف الصور الزيتية والمباني القديمة وتنبيض الورق.
خاصية تخفيف ضعيفة
ويمكن أن يظهر过氧化氢 خاصية تخفيف (يُحمل إلى O₂) عندما يتعرض لمعامل أكسدة أقوى في ظروف محددة. على سبيل المثال potassium permanganate (KMnO₄) و chlorine gas (Cl₂):
2KMnO₄ + 5H₂O₂ + 3H₂SO₄ → 2MnSO₄ + K₂SO₄ + 5O₂↑ + 8H₂O
H₂O₂ + Cl₂ → 2HCl + O₂
حمضية ضعيفة
يعتبر过氧化氢 حمض dibasic ضعيف ويتحلل بمرتين في محلول الماء. ويعتبر ثابت تفككه الأول صغير نسبيًا (pKa1 = 11.64)، وثابت تفككه الثاني أصغر (pKa2 = 25). ويمكن أن يتفاعل مع القواعد القوية بتفاعل нейтрализа حمضية-قوية. على سبيل المثال sodium hydroxide (NaOH):
H₂O₂ ⇌ H⁺ + HO₂⁻ Ka1 = 2.3×10⁻¹²
HO₂⁻ ⇌ H⁺ + O₂⁻ Ka2 = 10⁻²⁵
H₂O₂ + 2NaOH → Na₂O₂ + 2H₂O
لذلك، يمكن أن يعتبر sodium peroxide (Na₂O₂) ملحًا ل过氧化氢 إلى حد ما.
بيانات توكسولوجية过氧化氢
تحتوي بيانات توكسولوجية过氧化氢 على ما يلي:
يكون LD50 2000 rag/kg (تناول أمني للفئران).
GRAS (Food and Drug Administration, §184.1366, 2000).
لم يتم تحديد intake المعياري اليومي المقبول (يُستخدم فقط في حالة عدم توفر طريقة أفضل لحماية الحليب; Food and Agriculture Organization/World Health Organization, 2001).
يمكن أن يؤدي التعرض متكرر إلى过氧化氢 إلى التهاب الجلد والشmonary والقص两性. في حالة التسمم بالاستهلاك، قد تظهر أعراض مثل الألم في البطن والألم في الصدر و असهب والتقيض وارتفاع درجة الحرارة وتفск الش结膜 والجلد. في بعض الحالات، قد تظهر الإعطال البصرية والهجمات وparesis. في الولايات المتحدة الأمريكية، تُحدد концентрация المسموح بها ل过氧化氢 بالشكل الشائع 1.4 mg/m³.
China and chemical raw material suppliers, welcome to inquire,Contact us:https://www.yuhanchemi.com/contact