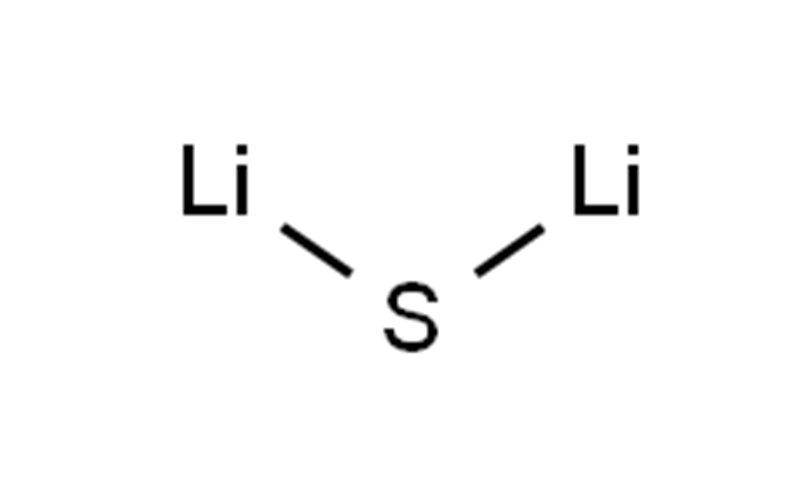
| Химические свойства | Сульфид лития — неорганическое соединение с формулой Li2S. Он кристаллизуется в антифлюоритовый мотив, описываемый как соль (Li+)2S2−. Он образует твердый желтовато-белый расплывающийся порошок. На воздухе он легко гидролизуется с выделением сероводорода (запах тухлых яиц) Сульфид лития получают путем обработки лития серой. Эту реакцию удобно проводить в безводном аммиаке. Растворимый в ТГФ триэтилборановый аддукт сульфида лития можно получить с использованием супергидрида.
Сульфид лития (Li2S) считается перспективным катодным материалом из-за его высокой теоретической емкости, высокой температуры плавления, доступного объемного расширения и литиевого состава. |
| Физические свойства | Сульфид лития, Li2S, является антифлюоритовым полупроводником с шириной запрещенной зоны 3,865 эВ. Он также имеет точно такое же количество валентных электронов, Ne, и атомный номер, Z, как и диборид магния, MgB2. Оба имеют почти одинаковый вес формулы. Это квалифицирует Li2S как материал, подобный дибориду магния. Li2S проходит тот же вычислительный тест на сверхпроводимость, что и MgB2. Сульфид лития является хорошо изученным материалом, хотя никогда не испытывался на сверхпроводимость. Li2S может существовать в двух формах: орторомбической и кубической. Орторомбическая форма принадлежит к пространственной группе Pmnb и имеет размеры: a = 3,808Å; b = 6,311Å; c = 7,262Å. Он имеет плотность 1,75 г/см3. Кубическая версия имеет плотность 1,63 г/см3, принадлежит к пространственной группе Fm-3m и имеет кубические размеры 4,046Å. Электронная структура и плотность состояний указывают на то, что кубический Li2S является непрямозонным полупроводником с шириной запрещенной зоны 3,865 эВ. Сульфид лития плавится в диапазоне температур от 900 до 975 градусов по Цельсию. |
| Применение | Сульфид лития изучался как сверхпроводник типа MgB2. Он также используется в качестве катодного материала в перезаряжаемых литий-серных батареях. |
| Применение | Сульфид лития (Li2S) — это продукт, специально разработанный для использования в высокопроизводительных батареях, который может применяться как электродный материал или как прекурсор для твердых электролитов. Он как электродный материал не только обладает высокой емкостью, но и преодолевает многие проблемы, вызванные электродами из чистой серы. Сульфид лития — это антифлюоритовый полупроводник (ширина запрещенной зоны 3,865 эВ). Он существует в орторомбической и кубической структурах. Плотности орторомбической и кубической структур составляют 1,75 г/см3 и 1,63 г/см3 соответственно. Сульфид лития изучался как сверхпроводник типа MgB2. Он также используется в качестве катодного материала в перезаряжаемых литий-серных батареях. |
| Приготовление | Сульфид лития, Li2S, образуется в реакции лития с серой в жидком аммиаке, путем разложения этанольного аддукта гидросульфида лития с этанолятом лития и, совсем недавно, путем реакции сероводорода с амилатом лития с получением гидросульфида лития, LiSH, который термически разлагается в вакууме с получением сульфида. Очень высококачественный безводный сульфид лития может быть получен путем реакции металлического лития и сероводорода в тетрагидрофуране, если принять меры для исключения воды. Продукт реакции фильтруется из реакционной среды и подвергается вакуумной сушке для удаления тетрагидрофурана и разложения небольшого количества гидросульфида лития, который образуется. Сообщается, что сульфид лития имеет антифлюоритовую структуру. Сульфид лития легко гидролизуется даже водой на воздухе, давая сероводород. Сульфид также реагирует с серой с образованием различных полисульфидов. |
| Общее описание | Сульфид лития — это антифлюоритовый полупроводник (ширина запрещенной зоны 3,865 эВ). Он существует в орторомбической и кубической структурах. Плотность орторомбической и кубической структур составляет 1,75 г/см3 и 1,63 г/см3 соответственно. |
| Токсикология | Большие дозы ионов лития вызывают головокружение и упадок сил, а также могут вызвать повреждение почек, если потребление натрия ограничено. Сообщалось об обезвоживании, потере веса, дерматологических эффектах и нарушениях функции щитовидной железы. Могут возникнуть эффекты центральной нервной системы, включающие невнятную речь, нечеткое зрение, потерю чувствительности, атаксию и судороги. Диарея, рвота и нервно-мышечные эффекты, такие как тремор, клонус и гиперактивные рефлексы, могут возникнуть в результате многократного воздействия ионов лития. |
| Метод производства | Непосредственно соедините элементы, то есть смешайте стехиометрические литий и серу, нагрейте их в никелевом тигле в инертной атмосфере (аргон или гелий) до расплавления и подождите, пока не образуется однородный расплав. Сульфат лития также можно восстановить с помощью угольного порошка. Возьмите смесь 100 г сульфата лития и 436 г угольного порошка и нагрейте ее в электрической печи до образования однородного расплава. Этот продукт хорошо растворяется в воде, а в водном растворе, который является сильнощелочным, образуются гидроксид лития и гидросульфид лития: Li2S+H2OLiOH+LiHSHольная кислота и сульфид лития быстро реагируют на холоде, образуя сероводород и хлорид лития: Li2S+HClLiCl+2H2S |