Lithium Sulfide12136-58-2
Atribut produk
| Titik leleh | >900 °C |
| Kepadatan | 1,66 g/mL pada suhu 25 °C (menyala) |
| suhu penyimpanan. | 2-8 °C |
| bentuk | Bubuk |
| Berat Jenis | 1.66 |
| warna | Kuning |
| Kelarutan Air | larut dalam air dan etanol |
| Struktur Kristal | Tipe CaF2 terbalik |
| Peka | Sensitif kelembaban |
| Sistem kristal | Kubus |
| Grup luar angkasa | FM3m |
| Konstanta kisi | a / nmb / nmc / nmα / oβ / oγ / oV / nm30.57180.57180.57189090900.187 |
| InChI | InChI = 1S / 2Li.S |
| InChIKey | ZWDBUTFCWLVLCQ-UHFFFAOYSA-N |
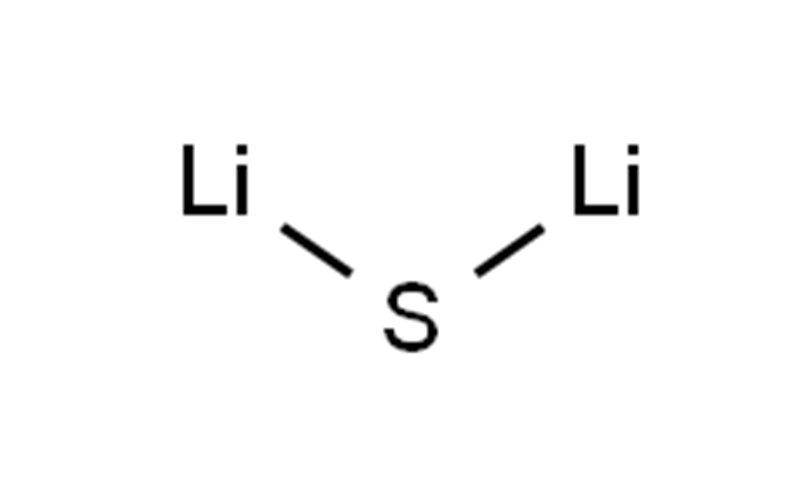
| TERSENYUM | S([Li])[Li] |
Informasi Keselamatan
| RIDADR | PBB 2923 8/PG 2 |
| WGK Jerman | 3 |
| RTECS | OJ6439500 |
| TSCA | Ya |
| Kelas Bahaya | 8 |
| Grup Pengepakan | II |
Penggunaan Dan Sintesis Lithium sulfida
| Sifat kimia | Litium sulfida adalah senyawa anorganik dengan rumus Li2S. Ini mengkristal dalam motif antifluorit, digambarkan sebagai garam (Li+)2S2−. Ini membentuk bubuk halus kuning-putih padat. Di udara, mudah terhidrolisis untuk melepaskan hidrogen sulfida (bau telur busuk) Litium sulfida disiapkan dengan mengolah litium dengan belerang. Reaksi ini dengan mudah dilakukan dalam amonia anhidrat. Tambahan trietilborana litium sulfida yang larut dalam THF dapat dihasilkan menggunakan superhidrida. Litium sulfida (Li2S) dianggap sebagai bahan katoda yang menjanjikan karena kapasitas teoretisnya yang tinggi, titik leleh yang tinggi, ekspansi volume yang terjangkau, dan komposisi litium. |
| Sifat fisik | Lithium Sulfida, Li2S, adalah semikonduktor anti-fluorit dengan celah pita 3.865 eV. Ini juga memiliki jumlah elektron valensi yang persis sama, Ne, dan nomor atom, Z, dengan magnesium diborida, MgB2. Keduanya memiliki berat formula yang hampir sama. Ini memenuhi syarat Li2S sebagai bahan seperti magnesium-diboride. Li2S lulus uji spesifik bahan komputasi yang sama untuk superkonduktivitas seperti MgB2.Lithium sulfida adalah bahan yang banyak dipelajari, meskipun tidak pernah diuji superkonduktivitas. Li2S dapat ada dalam dua bentuk: ortorhombik dan kubik. Bentuk ortorhombik termasuk dalam kelompok ruang Pmnb dan memiliki dimensi: a = 3.808Å; b = 6.311Å; c = 7.262Å. Ini memiliki kepadatan 1,75g / cm3. Versi kubik memiliki kepadatan 1.63g / cm3, termasuk dalam kelompok ruang Fm-3m dan memiliki dimensi kubik 4.046Å. Struktur elektronik dan kepadatan keadaan menunjukkan bahwa Li2S kubik adalah semikonduktor celah pita tidak langsung dengan celah pita 3.865 eV. Lithium sulfida meleleh antara 900 – 975 derajat celcius. |
| Menggunakan | Lithium sulfida telah dipelajari sebagai superkonduktor seperti MgB2. Ini juga digunakan sebagai bahan katoda dalam baterai lithium-sulfur yang dapat diisi ulang. |
| Menggunakan | Lithium sulfida (Li2S) adalah produk yang dirancang khusus untuk digunakan dalam baterai berkinerja tinggi yang dapat diterapkan sebagai bahan elektroda atau sebagai prekursor elektrolit padat. Ini sebagai bahan elektroda tidak hanya memiliki kapasitas tinggi tetapi juga mengatasi banyak masalah yang disebabkan oleh elektroda belerang murni. Lithium sulfida adalah semikonduktor anti fluorit (celah pita 3.865eV). Itu ada dalam struktur ortorhombik dan kubik. Kepadatan struktur ortorhombik dan kubik masing-masing adalah 1.75g/cm3 dan 1.63g/cm3. Litium sulfida telah dipelajari sebagai superkonduktor seperti MgB2. Ini juga digunakan sebagai bahan katoda dalam baterai lithium-sulfur yang dapat diisi ulang. |
| Persiapan | Litium sulfida, Li2S, terbentuk dalam tindak balas litium dengan belerang dalam amonia cair, oleh penguraian tambahan etanol litium hidrogen sulfida dengan litium etanol, dan, baru-baru ini, oleh tindak balas hidrogen sulfida dengan litium amilat untuk menghasilkan litium hidrogen sulfida, LiSH, yang terurai secara termal dalam ruang hampa untuk menghasilkan sulfida. Litium sulfida anhidrat berkualitas sangat tinggi dapat dibuat dengan reaksi logam litium dan hidrogen sulfida dalam tetrahidrofuran jika berhati-hati untuk mengecualikan air. Produk reaksi disaring dari media reaksi, dan dikeringkan vakum untuk menghilangkan tetrahidrofuran dan menguraikan sejumlah kecil litium hidrogen sulfida yang terbentuk. Litium sulfida dilaporkan memiliki struktur antifluorit. Litium sulfida mudah dihidrolisis, bahkan oleh air di udara, menghasilkan hidrogen sulfida. Sulfida juga bereaksi dengan belerang untuk membentuk berbagai polisulfida. |
| Deskripsi Umum | Litium sulfida adalah semikonduktor anti fluorit (celah pita 3.865eV). Ia wujud dalam struktur ortorhombik dan kubik. Ketumpatan struktur ortorhombik dan kubik masing-masing ialah 1.75g/cm3 dan 1.63g/cm3. |
| Toksikologi | Lithium ion dosis besar telah menyebabkan pusing dan sujud, dan dapat menyebabkan kerusakan ginjal jika asupan natrium terbatas. Dehidrasi, penurunan berat badan, efek dermatologis, dan gangguan tiroid telah dilaporkan. Efek sistem saraf pusat yang meliputi bicara tidak jelas, penglihatan kabur, kehilangan sensorik, ataksia, dan kejang dapat terjadi. Diare, muntah, dan efek neuromuskular seperti tremor, klonus, dan refleks hiperaktif dapat terjadi sebagai akibat dari paparan lithium ion berulang. |
| Metode produksi | Gabungkan unsur-unsur secara langsung, yaitu campurkan lithium stoikiometrik dan belerang, panaskan dalam wadah nikel di bawah atmosfer lembam (argon atau helium) sampai meleleh, dan tunggu sampai lelehan seragam terbentuk. Lithium sulfat juga dapat dikurangi dengan bubuk karbon. Ambil campuran 100g lithium sulfat dan 436g bubuk karbon, dan panaskan dalam tungku listrik sampai terbentuk lelehan yang seragam. Produk ini sangat larut dalam air, dan litium hidroksida dan litium hidrosulfida terbentuk dalam larutan berair, yang sangat basa: Li2S + H2OLiOH + LiHSHasam ydrochloric dan lithium sulfida bereaksi cepat saat dingin untuk menghasilkan hidrogen sulfida dan litium klorida: Li2S + HClLiCl + 2H2S |