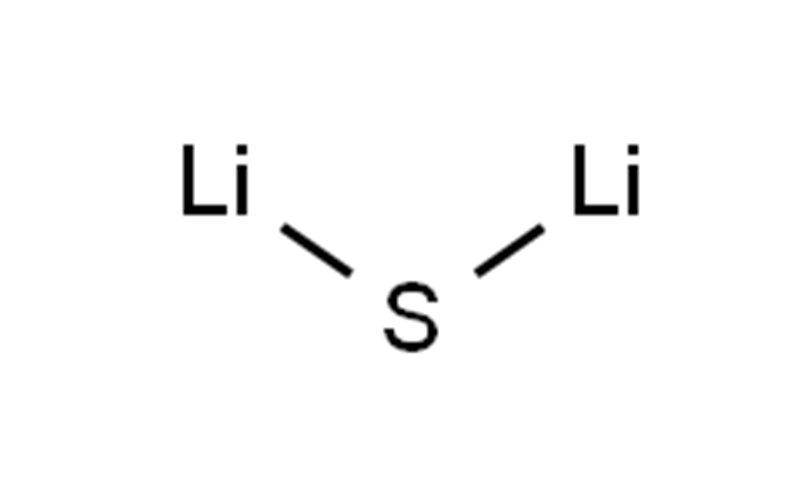
硫化リチウムCAS12136-58-2Li2S
製品属性
| 融点 | >900°C |
| 密度 | 25 °Cで1.66 g / mL(点灯) |
| 保管温度。 | 2-8°C |
| 形 | 粉 |
| 比重 | 1.66 |
| 色 | 黄色 |
| 水溶性 | 水とエタノールに溶ける |
| 結晶構造 | リバースCaF2タイプ |
| 敏感 | 湿気に敏感 |
| クリスタルシステム | 三乗 |
| スペース グループ | FM3メートル |
| 格子定数 | a/nmb/nmc/nmα/oβ/oγ/oV/nm30.57180.57180.57189090900.187 |
| インチインチ | インチI=1S/2Li.S |
| インチアイキー | ZWDBUTFCWLVLCQ-UHFFFAOYSA-N |
| 笑顔 | S([Li])[Li] |
安全情報
| リダドル | 国連2923 8/PG 2 |
| WGK ドイツ | 3 |
| RTECSの | OJ6439500 |
| TSCAの | はい |
| ハザードクラス | 8 |
| 梱包グループ | II |
硫化リチウムの使用と合成
| 化学的性質 | 硫化リチウムは、式Li2Sの無機化合物です。それは、塩(Li+)2S2−として説明される反蛍石モチーフで結晶化します。固体の黄白色潮解性粉末を形成します。空気中では加水分解しやすく硫化水素(腐った卵の臭い)を放出します 硫化リチウムは、リチウムを硫黄で処理することによって調製されます。この反応は、無水アンモニア中で便利に行われます。硫化リチウムのTHF可溶性トリエチルボラン付加物は、過水素化物を使用して生成できます。 硫化リチウム (Li2S) は、その高い理論容量、高い融点、手頃な価格の体積膨張、およびリチウム組成により、有望な正極材料と考えられています。 |
| 物理的特性 | 硫化リチウム Li2S は、バンドギャップが 3.865 eV の抗蛍石半導体です。また、二ホウ化マグネシウムMgB2とまったく同じ価電子数Neと原子番号Zを持っています。どちらもほぼ同じ式の重みを持っています。これにより、Li2Sは二ホウ化マグネシウムのような材料として認定されます。Li2S は、MgB2 と同じ超伝導に関する計算材料固有のテストに合格しています。 硫化リチウムは、超伝導についてテストされたことはありませんが、よく研究されている材料です。Li2Sは斜方晶と立方の2つの形で存在できます。斜方晶型は空間群Pmnbに属し、次元はa = 3.808Åです。b = 6.311Å;c = 7.262Åです。密度は1.75g/cm3です。立方バージョンの密度は1.63g/cm3で、空間群Fm-3mに属し、立方寸法は4.046Åです。電子構造と状態密度は、立方晶Li2Sがバンドギャップ3.865eVの間接バンドギャップ半導体であることを示しています。硫化リチウムは摂氏900〜975度の間で溶けます。 |
| 用途 | 硫化リチウムは、MgB2様超伝導体として研究されています。また、充電式リチウム硫黄電池の正極材料としても使用されます。 |
| 用途 | 硫化リチウム(Li2S)は、電極材料として、または固体電解質の前駆体として適用できる高性能電池に使用するために特別に設計された製品です。電極材料として、容量が高いだけでなく、純硫黄電極によって引き起こされる多くの問題を克服します。 硫化リチウムは、抗蛍石半導体(バンドギャップ3.865eV)です。斜方晶型と立方体の構造に存在します。斜方晶構造と立方構造の密度は、それぞれ1.75g / cm3と1.63g / cm3です。 硫化リチウムは、MgB2様超伝導体として研究されています。また、充電式リチウム硫黄電池の正極材料としても使用されます。 |
| 準備 | 硫化リチウム、Li2Sは、液体アンモニア中でのリチウムと硫黄の反応、硫化水素リチウムのエタノール付加物とエタノール酸リチウムの分解、および最近では、硫化水素とアミレートリチウムの反応によって硫化水素リチウム、LiSHを生成し、真空中で熱分解して硫化物を生成します。水を排除するように注意すれば、テトラヒドロフラン中でリチウム金属と硫化水素を反応させることにより、非常に高品質の無水硫化リチウムを調製できます。反応生成物を反応媒体からろ過し、真空乾燥させてテトラヒドロフランを除去し、生成する少量の硫化水素リチウムを分解します。硫化リチウムは反蛍石構造を持っていると報告されています。硫化リチウムは、空気中の水によっても容易に加水分解され、硫化水素を生成します。硫化物は硫黄とも反応してさまざまな多硫化物を形成します。 |
| 総記 | 硫化リチウムは、抗蛍石半導体(バンドギャップ3.865eV)です。斜方晶型と立方体の構造に存在します。斜方晶構造と立方構造の密度は、それぞれ1.75g / cm3と1.63g / cm3です。 |
| 毒物学 | 大量のリチウムイオンはめまいや衰弱を引き起こし、ナトリウム摂取量が制限されると腎臓の損傷を引き起こす可能性があります。脱水症状、体重減少、皮膚科的影響、甲状腺障害が報告されています。ろれつが回らない、かすみ目、感覚喪失、運動失調、けいれんなどの中枢神経系への影響が発生する可能性があります。リチウムイオンに繰り返し曝露された結果、下痢、嘔吐、振戦、クローヌス、多動反射などの神経筋への影響が発生する可能性があります。 |
| 製造方法 | 元素を直接結合し、つまり化学量論的リチウムと硫黄を混合し、不活性雰囲気(アルゴンまたはヘリウム)下のニッケルるつぼで溶融するまで加熱し、均一な溶融物が形成されるまで待ちます。硫酸リチウムは炭素粉末で還元することもできます。硫酸リチウム100gと炭素粉末436gの混合物を取り、均一な溶融物が形成されるまで電気炉で加熱します。この製品は水に非常に溶けやすく、水溶液中に水酸化リチウムと硫化水素リチウムが形成され、強アルカリ性です:Li2S + H2OLiOH + LiHSHヒドロ塩素酸と硫化リチウムは、冷えると急速に反応して硫化水素と塩化リチウムを生成します:Li2S + HClLiCl + 2H2S |
当社は、危険化学物質、可燃性および爆発性化学物質、有毒化学物質(合法輸出)、超高純度および高純度試薬を専門としています。お問い合わせを歓迎します。
梱包と発送