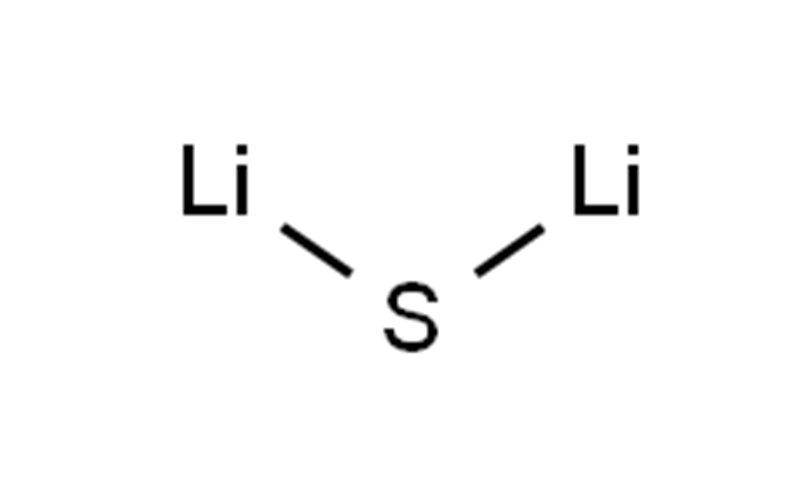
硫化锂CAS12136-58-2Li2S
产品属性
| 熔点 | >900°C |
| 密度 | 25°C时为1.66 g/mL(点燃) |
| 储存温度 | 2-8°C |
| 形式 | 粉 |
| 比重 | 1.66 |
| 颜色 | 黄色 |
| 水溶性 | 溶于水和乙醇 |
| 晶体结构 | 反向 CaF2 型 |
| 灵敏 | 湿气敏感 |
| 晶系 | 立方体 |
| 空间组 | 调频3m |
| 晶格常数 | a/nmb/nmc/nmα/oβ/oγ/oV/nm30.57180.57180.57189090900.187 |
| 英寸 | 英寸I=1S/2Li.S |
| InChIKey | ZWDBUTFCWLVLCQ-UHFFFAOYSA-N |
| 微笑 | S([Li])[Li] |
安全信息
| 里达德尔 | UN 2923 8/PG 2 |
| WGK 德国 | 3 |
| RTECS的 | OJ6439500 |
| TSCA公司 | 是的 |
| 危险等级 | 8 |
| 包装组 | 第二 |
硫化锂的用途和合成
| 化学性质 | 硫化锂是分子式为Li2S的无机化合物。它在反萤石基序中结晶,被描述为盐 (Li+)2S2−。形成固体黄白色潮解粉。在空气中,它很容易水解释放出硫化氢(臭鸡蛋味)硫化锂是通过用硫处理锂来制备的。该反应在无水氨中方便地进行。硫化锂的THF可溶性三乙基硼烷加合物可以使用超氢化物生成。 硫化锂 (Li2S) 因其高理论容量、高熔点、经济实惠的体积膨胀和锂成分而被认为是有前途的正极材料。 |
| 物理性质 | 硫化锂,Li2S,是一种带隙为3.865 eV的抗萤石半导体。它还具有与二硼化镁 MgB2 完全相同的价电子数 Ne 和原子序数 Z。两者的配方重量几乎相同。这使得 Li2S 成为类二硼化镁材料。Li2S 通过了与 MgB2 相同的计算材料超导性测试。 硫化锂是一种被广泛研究的材料,但从未进行过超导性测试。Li2S 可以以两种形式存在:斜方晶和立方。斜方形属于空间群 Pmnb,尺寸为:a = 3.808Å;b = 6.311Å;c = 7.262Å。它的密度为 1.75g/cm3 。立方版本的密度为1.63g/cm3,属于空间群Fm-3m,立方尺寸为4.046Å。电子结构和态密度表明,立方Li2S是一种间接带隙半导体,带隙为3.865 eV。硫化锂在 900 – 975 摄氏度之间熔化。 |
| 使用 | 硫化锂已被研究为类 MgB2 超导体。它还用作可充电锂硫电池的正极材料。 |
| 使用 | 硫化锂(Li2S)是专门设计用于高性能电池的产品,既可以用作电极材料,也可以作为固体电解质的前体。它作为电极材料,不仅容量大,而且克服了纯硫电极带来的许多问题。 硫化锂是一种抗萤石半导体(带隙 3.865eV)。它存在于斜方晶和立方结构中。斜方和立方结构的密度分别为1.75g/cm3和1.63g/cm3。 硫化锂已被研究为类 MgB2 超导体。它还用作可充电锂硫电池的正极材料。 |
| 制备 | 硫化锂 Li2S 是在锂与硫在液氨中反应时形成的,通过硫化氢锂的乙醇加合物与乙醇酸锂分解,最近,硫化氢与淀粉酸锂反应生成硫化氢锂 LiSH,在真空中热分解生成硫化物。如果注意排除水,可以通过锂金属和硫化氢在四氢呋喃中反应制备非常高质量的无水硫化锂。将反应产物从反应介质中过滤出来,真空干燥,除去四氢呋喃,分解形成的少量硫化氢锂。据报道,硫化锂具有反萤石结构。硫化锂很容易被水解,即使是空气中的水,也会产生硫化氢。硫化物还与硫反应形成多种多硫化物。 |
| 一般描述 | 硫化锂是一种抗萤石半导体(带隙 3.865eV)。它存在于斜方晶和立方结构中。斜方和立方结构的密度分别为1.75g/cm3和1.63g/cm3。 |
| 毒物学 | 大剂量的锂离子会导致头晕和虚脱,如果钠摄入量有限,可能会导致肾脏损伤。据报道,脱水、体重减轻、皮肤病学影响和甲状腺功能紊乱。可能会出现中枢神经系统影响,包括言语不清、视力模糊、感觉丧失、共济失调和抽搐。反复接触锂离子可能会出现腹泻、呕吐和神经肌肉影响,如震颤、阵挛和过度活跃的反射。 |
| 生产方法 | 直接将元素混合,即将化学计量的锂和硫混合,在惰性气氛(氩气或氦气)下在镍坩埚中加热直至熔化,等待形成均匀的熔体。硫酸锂也可以用碳粉还原。取100g硫酸锂和436g碳粉的混合物,在电炉中加热至形成均匀的熔体。本品极易溶于水,水溶液中形成氢氧化锂和氢硫化锂,呈强碱性:Li2S+H2OLiOH+LiHSH羟氯酸与硫化锂冷时反应迅速,生成硫化氢和氯化锂:Li2S+HClLiCl+2H2S |