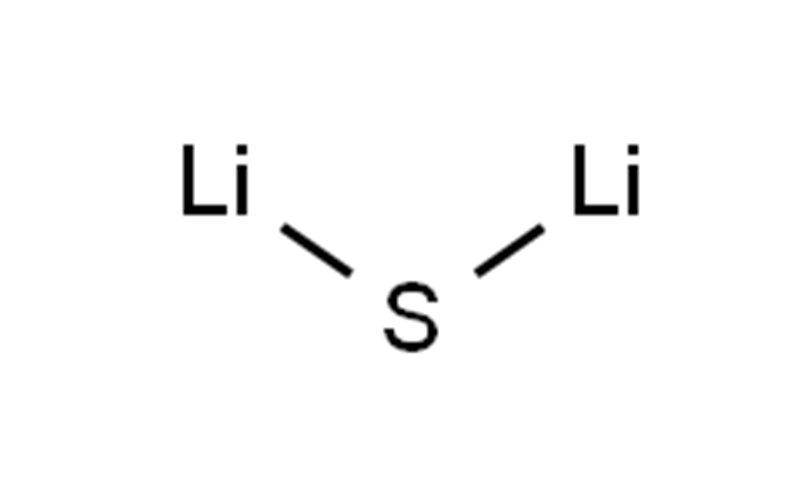
Sulfuro de litioCAS12136-58-2Li₂S
Atributos do produto
| Ponto de fusão | >900°C |
| densidade | 1,66 g/ml a 25 °C (lit.) |
| Temperatura de armazenamento. | 2-8°C |
| forma | Pó |
| Gravidade específica | 1.66 |
| Cor | Amarelo |
| Solubilidade em água | solúvel em água e etanol |
| Estrutura Cristalina | Tipo CaF2 reverso |
| Sensível | Sensível à umidade |
| sistema de cristal | Cubo |
| Grupo espacial | Fm3m |
| Constante de rede | a/nmb/nmc/nmα/oβ/oγ/oV/nm30.57180.57180.57189090900.187 |
| InChI | InChI=1S/2Li.S |
| InChIKey | ZWDBUTFCWLVLCQ-UHFFFAOYSA-N |
| SORRISOS | S([Li])[Li] |
Informação de Segurança
| RIDADR | ONU 2923 8/PG 2 |
| WGK Alemanha | 3 |
| RTECS | OJ6439500 |
| TSCA | Sim |
| Classe de perigo | 8 |
| Grupo de embalagem | II |
Uso e síntese de sulfeto de lítio
| Propriedades quimicas | Sulfeto de lítio é o composto inorgânico com a fórmula Li2S. Cristaliza no motivo antifluorita, descrito como sal (Li+)2S2−. Forma um pó deliquescente sólido amarelo-esbranquiçado. No ar, ele hidrolisa facilmente para liberar sulfeto de hidrogênio (odor de ovo podre) O sulfeto de lítio é preparado tratando o lítio com enxofre. Esta reação é convenientemente conduzida em amônia anidra. O aduto de trietilborano solúvel em THF do sulfeto de lítio pode ser gerado usando superhidreto. O sulfeto de lítio (Li2S) é considerado o material catódico promissor por sua alta capacidade teórica, alto ponto de fusão, expansão de volume acessível e composição de lítio. |
| Propriedades físicas | O sulfeto de lítio, Li2S, é um semicondutor antifluorita com um band-gap de 3.865 eV. Ele também tem exatamente a mesma contagem de elétrons de valência, Ne, e número atômico, Z, que o diboreto de magnésio, MgB2. Ambos têm quase o mesmo peso de fórmula. Isso qualifica o Li2S como um material semelhante ao diboreto de magnésio. O Li2S passa no mesmo teste computacional específico de material para supercondutividade que o MgB2.O sulfeto de lítio é um material muito estudado, embora nunca testado para supercondutividade. O Li2S pode existir em duas formas: ortorrômbico e cúbico. A forma ortorrômbica pertence ao grupo espacial Pmnb e tem dimensões: a = 3.808Å; b = 6.311Å; c = 7.262Å. Tem densidade de 1,75g / cm3. A versão cúbica tem densidade de 1,63g/cm3, pertence ao grupo espacial Fm-3m e tem dimensões cúbicas 4,046Å. A estrutura eletrônica e a densidade de estados indicam que o Li2S cúbico é um semicondutor indireto com um intervalo de banda de 3,865 eV. O sulfeto de lítio derrete entre 900 e 975 graus centígrados. |
| Usa | O sulfeto de lítio tem sido estudado como um supercondutor semelhante ao MgB2. Também é usado como material catódico em baterias recarregáveis de lítio-enxofre. |
| Usa | O sulfeto de lítio (Li2S) é um produto especialmente projetado para uso em baterias de alto desempenho que pode ser aplicado como material de eletrodo ou como precursor de eletrólitos sólidos. Como material de eletrodo, não só tem alta capacidade, mas também supera muitos problemas causados por eletrodos de enxofre puro. O sulfeto de lítio é um semicondutor antifluorita (bandgap 3.865eV). Existe em estruturas ortorrômbicas e cúbicas. As densidades das estruturas ortorrômbicas e cúbicas são 1,75 g/cm3 e 1,63 g/cm3, respectivamente. O sulfeto de lítio tem sido estudado como um supercondutor semelhante ao MgB2. Também é usado como material catódico em baterias recarregáveis de lítio-enxofre. |
| Preparação | O sulfeto de lítio, Li2S, é formado na reação do lítio com enxofre em amônia líquida, pela decomposição do aduto de etanol de sulfeto de hidrogênio de lítio com etanolato de lítio e, mais recentemente, pela reação de sulfeto de hidrogênio com amilato de lítio para produzir sulfeto de hidrogênio de lítio, LiSH, que é decomposto termicamente no vácuo para produzir o sulfeto. Um sulfeto de lítio anidro de alta qualidade pode ser preparado pela reação de metal de lítio e sulfeto de hidrogênio em tetraidrofurano, se for tomado cuidado para excluir a água. O produto da reação é filtrado do meio de reação e é seco a vácuo para remover o tetrahidrofurano e decompor a pequena quantidade de sulfeto de hidrogênio de lítio que se forma. O sulfeto de lítio é relatado como tendo uma estrutura antifluorita. O sulfeto de lítio é facilmente hidrolisado, mesmo pela água no ar, produzindo sulfeto de hidrogênio. O sulfeto também reage com o enxofre para formar uma variedade de polissulfetos. |
| Descrição geral | O sulfeto de lítio é um semicondutor antifluorita (bandgap 3.865eV). Existe em estruturas ortorrômbicas e cúbicas. As densidades das estruturas ortorrômbicas e cúbicas são 1,75 g/cm3 e 1,63 g/cm3, respectivamente. |
| Toxicologia | Grandes doses de íon de lítio causaram tontura e prostração e podem causar danos aos rins se a ingestão de sódio for limitada. Desidratação, perda de peso, efeitos dermatológicos e distúrbios da tireoide foram relatados. Podem ocorrer efeitos no sistema nervoso central que incluem fala arrastada, visão turva, perda sensorial, ataxia e convulsões. Diarreia, vômitos e efeitos neuromusculares, como tremor, clônus e reflexos hiperativos, podem ocorrer como resultado da exposição repetida ao íon de lítio. |
| Método de produção | Combine diretamente os elementos, ou seja, misture lítio estequiométrico e enxofre, aqueça-os em um cadinho de níquel sob uma atmosfera inerte (argônio ou hélio) até que derretam e espere até que um derretimento uniforme seja formado. O sulfato de lítio também pode ser reduzido com pó de carbono. Pegue uma mistura de 100g de sulfato de lítio e 436g de pó de carbono e aqueça-a em um forno elétrico até formar um derretimento uniforme. Este produto é muito solúvel em água, e hidróxido de lítio e hidrossulfeto de lítio são formados na solução aquosa, que é fortemente alcalina: Li2S + H2OLiOH + LiHSO ácido clorídrico e sulfeto de lítio reagem rapidamente quando frio para produzir sulfeto de hidrogênio e cloreto de lítio: Li2S + HClLiCl + 2H2S |
Nossa empresa é especializada em produtos químicos perigosos, produtos químicos inflamáveis e explosivos, produtos químicos tóxicos (exportação legal), reagentes ultrapuros e de alta pureza. Bem-vindo a entrar em contato conosco.
Embalagem e envio