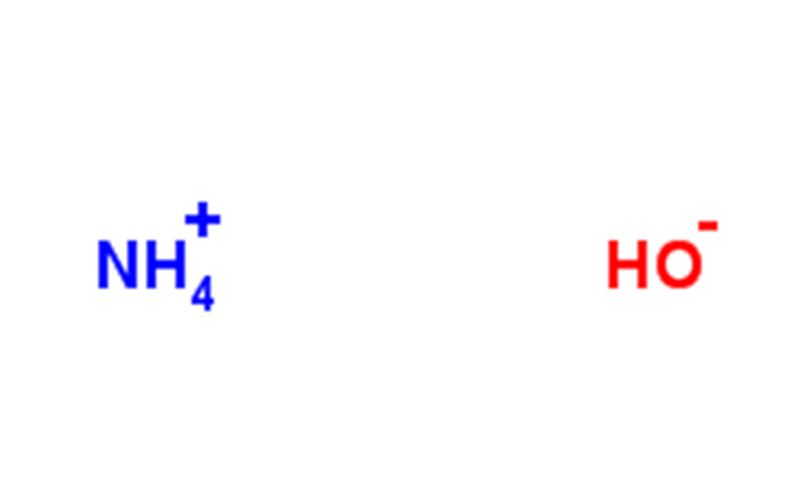Сверхчистый аммиак (водный раствор NH₃) ppt
Информация о продукте:
| параметр | США | минимум | предельный | |
| Лаборатория (NH3) | % | 28.0 | 30.0 | |
| Цвет | Аппа | 5 | ||
| Хлорид (Cl) | Промилле | 0.01 | ||
| Карбонат (CO3) | Промилле | 1 | ||
| Сульфат (SO4) | Промилле | 0.01 | ||
| Фосфат (PO4) | Промилле | 0.01 | ||
| Восстановительное вещество, перманганат (KMnO4) | Промилле | 0.5 | ||
| Максимальная примесь | США | минимум | предельный | |
| Алюминий (Al) | ppb | 0.05 | ||
| Сурьма (Sb) | ppb | 0.05 | ||
| Мышьяк (As) | ppb | 0.05 | ||
| Барий (Ба) | ppb | 0.05 | ||
| Бериллий (BE) | ppb | 0.05 | ||
| Висмут (Би) | ppb | 0.05 | ||
| Бор (В) | ppb | 0.05 | ||
| Кадмий (Cd) | ppb | 0.05 | ||
| Кальций (Ca) | ppb | 0.05 | ||
| Хром (Cr) | ppb | 0.05 | ||
| Кобальт (Co) | ppb | 0.05 | ||
| Медь (Cu) | ppb | 0.05 | ||
| Галлий (Ga) | ppb | 0.05 | ||
| Германий (Ge) | ppb | 0.05 | ||
| Золото (AU) | ppb | 0.05 | ||
| Железо (железо) | ppb | 0.05 | ||
| Свинец (Pb) | ppb | 0.05 | ||
| Литий (Li) | ppb | 0.05 | ||
| Магний (Mg) | ppb | 0.05 | ||
| Марганец (Mn) | ppb | 0.05 | ||
| Молибден (Mo) | ppb | 0.05 | ||
| Никель (Ni) | ppb | 0.05 | ||
| Ниобий (Nb) | ppb | 0.05 | ||
| Калий (К) | ppb | 0.05 | ||
| Серебро (Ag) | ppb | 0.05 | ||
| Натрий (Na) | ppb | 0.05 | ||
| Стронций (Sr) | ppb | 0.05 | ||
| Тантал (Ta) | ppb | 0.05 | ||
| Таллий (Tl) | ppb | 0.05 | ||
| Олово (Sn) | ppb | 0.05 | ||
| Титан (Ti) | ppb | 0.05 | ||
| Ванадий (V) | ppb | 0.05 | ||
| Цинк (Zn) | ppb | 0.05 | ||
| Цирконий (Zr) | ppb | 0.05 | ||
| Количество частиц | США | минимум | предельный | |
| ≧ 0,1 мкм | шт/мл | 200 | ||
| ≧ 0,2 мкм | шт/мл | 50 | ||
| ≧ 0,5 мкм | шт/мл | 30 | ||
| ≧ 1,0 мкм | шт/мл | 10 | ||
Физико-химические свойства
- Плотность: ~0,88 г/см³ (при 20°C)
- Температура кипения: ~36°C (варьируется в зависимости от концентрации)
- Температура плавления: ~-77°C
- pH: Сильнощелочной (pH >11)
- Растворимость: Полностью смешивается с водой, реагирует с кислотами
- Разложение: Со временем выделяет аммиак (NH₃), особенно при нагревании
Разница между аммиаком и моногидратом аммиака
1. Моногидрат аммиака
Моногидрат аммиака является чистым веществом, химическая формула: NH3· H2O, которая является слабым основанием. Аммиак в основном растворим в воде с образованием моногидрата аммиака, NH3+H2O⇌NH3· H2O。 Он является основным компонентом аммиака (аммиак – это смесь), который является летучим и выделяет аммиак. Он имеет сильный резкий запах и может смешиваться с этанолом. Он вызывает коррозию и слезы. Моногидрат аммиака представляет собой слабый электролит, который может быть частично ионизирован в воду до ионов аммония и гидроксида (поэтому иногда их называют гидроксидом аммония) и является слабощелочным: NH₃· H₂O====(NH₄⁺)+(OH⁻)
2. Аммиак
Аммиак, также известный как аммиачная вода, в основном состоит из NH3· H2O, водный раствор аммиака, бесцветный и прозрачный, имеет резкий запах. Аммиак представляет собой смесь, смесь растворенного в воде газообразного аммиака, то есть водный раствор моногидрата аммиака. Промышленный аммиак представляет собой водный раствор, содержащий 25% ~ 28% аммиака, и только небольшая часть молекул аммиака вступает в реакцию с водой с образованием моногидрата аммиака, который является слабой щелочью, которая существует только в аммиаке.
Аммиак содержит ионы NH₄⁺, NH₂⁻, OH⁻ и H₃O⁺. Моногидрат аммония получают растворенным в воде моногидратом аммония, при этом Kb = 1,8×10-5 этой реакции. Значение pH 1М аммиака составляет 11,63, и около 0,42% NH₃ становится NH₄+.
Разница в природе
1. Свойства моногидрата аммиака
Моногидрат аммония обладает определенным коррозионным действием. Коррозия меди относительно сильна, сталь относительно бедна, а коррозия цемента невелика. Также он оказывает определенное коррозионное воздействие на древесину. Моногидрат аммиака нестабилен и легко разлагается с образованием аммиака и воды. Поскольку аммиак летуч, его следует хранить запечатанным в коричневом или темном флаконе с реагентом с резиновой пробкой и поместить в прохладное темное место.
2. Свойства аммиака
Аммиак является щелочным и хорошим осаждающим агентом, который может вступать в реакцию с различными ионами металлов с образованием нерастворимых слабых оснований или амфотерных гидроксидов. Аммиак также проявляет слабые восстановительные свойства и может окисляться сильными окислителями. Лишь небольшая часть молекул аммиака вступает в реакцию с водой с образованием ионов аммония NH4+ и гидроксид-ионов OH-, которые являются слабощелочными. Аммиак может вступать в реакцию с кислотами с образованием солей аммония. Белый дым образуется, когда газообразный аммиак улетучивается из концентрированного аммиака и встречается с кислотным туманом, улетучившимся под действием летучих кислот, таких как концентрированная соляная кислота и концентрированная азотная кислота.
Основные области применения
- Полупроводниковая промышленность:
- Используется при очистке RCA (SC-1) для удаления органических веществ и частиц с пластин
- Незаменим в процессах травления и химико-механической планаризации (КМП)
- Производство электроники:
- Высокочистые щелочные травители для микроэлектроники и дисплеев
- Основные реагенты в отпаре фоторезиста
- Химия и синтез лекарственных средств:
- Для химических составов высокой чистоты
- Прекурсоры соединений на основе аммония в научных исследованиях и промышленности
- Экологические и аналитические приложения:
- Используется для производства сверхчистой воды и очистки сточных вод
- Реагенты в ИСП-МС и других методах анализа следовых следов
Безопасность и обращение
Аммиак, аммиак, NH3, бесцветный газ. Обладает сильным резким запахом. Плотность 0.7710. Относительная плотность 0.5971 (воздух=1.00). Его легко разжижать до бесцветной жидкости. Его можно сжижать под давлением при комнатной температуре (критическая температура 132,4°C, критическое давление 11,2 мегапаскаля, т.е. 112,2 атмосферы). Температура кипения -33,5°C. Он также легко затвердевает в снежное твердое вещество.
Температура плавления -77,75°C. Растворим в воде, этаноле и эфире. При высоких температурах он будет разлагаться на азот и водород, что оказывает восстановительное действие. В присутствии катализаторов он может окисляться до оксида азота. Из него производят жидкий азот, аммиак, азотную кислоту, соли аммония и амины. Он может быть получен путем прямого синтеза азота и водорода, которые могут обжечь слизистые оболочки кожи, глаз и органов дыхания, а если люди вдыхают слишком много, это может вызвать отек легких и даже смерть.
Химические свойства
Разъедающий
Аммиак обладает определенным коррозионным действием, а карбид аммиака более агрессивен. Коррозия меди относительно сильная, коррозия стали относительно слабая, а коррозия цемента небольшая. Также он оказывает определенное коррозионное воздействие на древесину. Это опасное химическое вещество, код опасности 82503.
Слабощелочной
В аммиаке присутствует следующее химическое равновесие:
NH3+H2O ===NH3· H2O (обратимая реакция)
NH3· H2O ===NH4+ +OHˉ (обратимая реакция) константа ионизации: K=1,8×10ˇ-5 (25°C)
Поэтому лишь небольшая часть молекул аммиака вступает в реакцию с водой с образованием иона аммония NH4+ и гидроксид-иона OH-, поэтому он слабощелочной.
(1) Он может сделать бесцветный тестовый раствор фенолфталеина красным, фиолетовый раствор лакмусовой бумажки синим, а влажную красную лакмусовую бумагу синим. Этот метод обычно используется в лабораториях для проверки на наличие NH3.
(2) Он может вступать в реакцию с кислотой с образованием аммонийной соли. Концентрированный аммиак встречается с летучими кислотами, такими как концентрированная соляная кислота или концентрированная азотная кислота, образуя белый дым. В случае с нелетучими кислотами (такими как серная кислота и фосфорная кислота) такого явления нет. Таким образом, этот метод может быть использован в лабораторных условиях для проверки наличия молекул аммиака в воде. В промышленности слабая щелочность аммиака используется для поглощения промышленных отходных газов серной кислоты и предотвращения загрязнения окружающей среды.
неустойчивость
Моногидрат аммиака нестабилен, хорошо пропускает свет и легко разлагается при нагревании с образованием аммиака и воды.
В лабораторных условиях аммиак можно получить путем нагревания твердой смеси гидроксида кальция и хлорида аммония или смешивания концентрированного аммиака с твердой каустической содой при комнатной температуре, что легко в установке и эксплуатации, причем концентрация аммиака получается больше, а эффект «фонтанного» эксперимента лучше.
Из-за летучей и нестабильной природы аммиака, аммиак следует укупоривать и хранить в коричневом или темном флаконе с реагентом в прохладном и темном месте.
Осаждения
Аммиак является хорошим осадителем, он может вступать в реакцию с различными ионами металлов с образованием нерастворимой слабой щелочи или амфотерного гидроксида.
Сложность
Аммиак и ионы Ag+, Cu2+, Cr3+, Zn2+ и другие могут подвергаться реакции комплексообразования, когда образуется небольшое количество аммиачной воды, нерастворимой слабой щелочи, а при избытке аммиака нерастворимые вещества превращаются в комплексные ионы и растворяются.
Редуцируемость
Аммиак проявляет слабые восстановительные свойства и может окисляться сильными окислителями.
Окисление
Водород в степени окисления +1 молекулы аммиака проявляет слабое окисление и может окислять сильные восстановители.