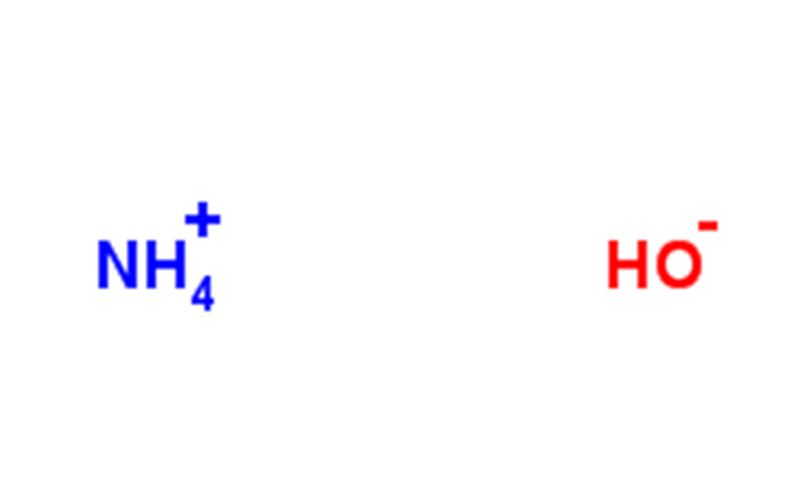Amonia ultramurni (larutan berair NH₃) tingkat ppt
Detil Produk:
| Parameter | Amerika Serikat | Minimum | Sangat | |
| Pengujian (NH3) | % | 28.0 | 30.0 | |
| warna | Appa | 5 | ||
| Klorida (Cl) | Ppm | 0.01 | ||
| Karbonat (CO3) | Ppm | 1 | ||
| Sulfat (SO4) | Ppm | 0.01 | ||
| Fosfat (PO4) | Ppm | 0.01 | ||
| Zat pereduksi, permanganat (KMnO4) | Ppm | 0.5 | ||
| Maksimum pengotor | Amerika Serikat | Minimum | Sangat | |
| Aluminium (Al) | Ppb | 0.05 | ||
| Antimon (Sb) | Ppb | 0.05 | ||
| Arsenik (Sebagai) | Ppb | 0.05 | ||
| Barium (Ba) | Ppb | 0.05 | ||
| Berilium (BE) | Ppb | 0.05 | ||
| Bismut (Bi) | Ppb | 0.05 | ||
| Boron (B) | Ppb | 0.05 | ||
| Kadmium (Cd) | Ppb | 0.05 | ||
| Kalsium (Ca) | Ppb | 0.05 | ||
| Kromium (Cr) | Ppb | 0.05 | ||
| Kobalt (Co) | Ppb | 0.05 | ||
| Tembaga (Cu) | Ppb | 0.05 | ||
| Galium (Ga) | Ppb | 0.05 | ||
| Germanium (Ge) | Ppb | 0.05 | ||
| Emas (AU) | Ppb | 0.05 | ||
| Besi (besi) | Ppb | 0.05 | ||
| Timbal (Pb) | Ppb | 0.05 | ||
| Litium (Li) | Ppb | 0.05 | ||
| Magnesium (mg) | Ppb | 0.05 | ||
| Mangan (Mn) | Ppb | 0.05 | ||
| Molibdenum (Mo) | Ppb | 0.05 | ||
| Nikel (Ni) | Ppb | 0.05 | ||
| Niobium (Nb) | Ppb | 0.05 | ||
| Kalium (K) | Ppb | 0.05 | ||
| Perak (Ag) | Ppb | 0.05 | ||
| Natrium (Na) | Ppb | 0.05 | ||
| Strontium (Sr) | Ppb | 0.05 | ||
| Tantalum (Ta) | Ppb | 0.05 | ||
| Talium (Tl) | Ppb | 0.05 | ||
| Timah (Sn) | Ppb | 0.05 | ||
| Titanium (Ti) | Ppb | 0.05 | ||
| Vanadium (V) | Ppb | 0.05 | ||
| Seng (Zn) | Ppb | 0.05 | ||
| Zirkonium (Zr) | Ppb | 0.05 | ||
| Jumlah partikel | Amerika Serikat | Minimum | Sangat | |
| ≧ 0,1 mikron | pcs/ml | 200 | ||
| ≧ 0,2 mikron | pcs/ml | 50 | ||
| ≧ 0,5 mikron | pcs/ml | 30 | ||
| ≧ 1.0 mikron | pcs/ml | 10 | ||
Sifat fisik dan kimia
- Kepadatan: ~ 0,88 g / cm³ (pada 20 ° C)
- Titik didih: ~36 °C (bervariasi dengan konsentrasi)
- Titik lebur: ~-77 °C
- pH: Sangat basa (pH >11)
- Kelarutan: Benar-benar larut dengan air, bereaksi dengan asam
- Dekomposisi: Melepaskan amonia (NH₃) dari waktu ke waktu, terutama saat dipanaskan
Perbedaan antara amonia dan amonia monohidrat
1. Amonia monohidrat
Amonia monohidrat adalah zat murni, rumus kimia: NH3 · H2O, yang merupakan basis yang lemah. Amonia sebagian besar larut dalam air untuk membentuk amonia monohidrat, NH3+H2O⇌NH3· H2O。 Ini adalah komponen utama amonia (amonia adalah campuran), yang mudah menguap dan lolos dari amonia. Ini memiliki bau menyengat yang kuat dan dapat larut dengan etanol. Ini korosif dan memicu air mata. Amonia monohidrat adalah elektrolit lemah, yang dapat diionisasi sebagian menjadi ion amonium dan hidroksida (oleh karena itu kadang-kadang disebut amonium hidroksida) dalam air, dan bersifat basa lemah: NH₃· H₂O====(NH₄⁺)+(OH⁻)
2. Amonia
Amonia, juga dikenal sebagai air amonia, terutama terdiri dari NH3 · H2O, larutan amonia berair, tidak berwarna dan transparan dan memiliki bau yang menyengat. Amonia adalah campuran, campuran gas amonia yang dilarutkan dalam air, yaitu larutan amonia monohidrat berair. Amonia industri adalah larutan berair yang mengandung 25% ~ 28% amonia, dan hanya sebagian kecil dari molekul amonia yang bereaksi dengan air untuk membentuk amonia monohidrat, yang merupakan alkali lemah yang hanya ada dalam amonia.
Amonia mengandung ion NH₄⁺, NH₂⁻, OH⁻ dan H₃O⁺. Amonia monohidrat diperoleh dengan amonia monohidrat yang dilarutkan dalam air, dan Kb = 1,8×10-5 dari reaksi ini. Nilai pH amonia 1M adalah 11,63, dan sekitar 0,42% NH₃ menjadi NH₄+.
Perbedaan alam
1. Sifat amonia monohidrat
Amonia monohidrat memiliki efek korosif tertentu. Korosi tembaga relatif kuat, korosi baja relatif buruk, dan korosi semen tidak besar. Ini juga memiliki efek korosif tertentu pada kayu. Amonia monohidrat tidak stabil dan mudah terurai untuk menghasilkan amonia dan air. Karena sifat amonia yang mudah menguap, amonia harus disimpan dalam botol reagen coklat atau gelap dengan sumbat karet dan ditempatkan di tempat yang sejuk dan gelap.
2. Sifat amonia
Amonia bersifat basa dan merupakan endapan yang baik, yang dapat bereaksi dengan berbagai ion logam untuk membentuk alkali lemah atau hidroksida amfoterik yang tidak larut. Amonia juga menunjukkan sifat pereduksi yang lemah dan dapat dioksidasi oleh oksidan kuat. Hanya sebagian kecil molekul amonia dalam amonia yang bereaksi dengan air untuk membentuk ion amonium NH4+ dan ion hidroksida OH-, yang bersifat basa lemah. Amonia dapat bereaksi dengan asam untuk membentuk garam amonium. Asap putih terjadi ketika gas amonia yang menguap oleh amonia pekat bertemu dengan kabut asam yang divolatilisasi oleh asam volatil, seperti asam klorida pekat dan asam nitrat pekat.
Aplikasi Kritis
- Industri semikonduktor:
- Untuk pembersihan RCA (SC-1) untuk menghilangkan bahan organik dan pencemaran zarah dari wafer
- Sangat diperlukan dalam proses etsa dan planarisasi kimia-mekanik (CMP)
- Manufaktur Elektronik:
- Etchant alkaline dengan kemurnian tinggi untuk mikroelektronika dan panel tampilan
- Reagen utama dalam pengupasan fotoresist
- Sintesis Kimia dan Farmasi:
- Untuk digunakan dalam formulasi kimia dengan kemurnian tinggi
- Prekursor senyawa berbasis amonium dalam penelitian dan industri
- Aplikasi Lingkungan & Analitis:
- Ini digunakan dalam produksi air ultramurni dan pengolahan air limbah
- Reagen dalam ICP-MS dan teknik analisis jejak lainnya
Keamanan dan penanganan
Amonia, Amonia, NH3, gas tidak berwarna. Ada bau menyengat yang kuat. Kepadatan 0,7710. Kepadatan relatif adalah 0,5971 (udara = 1,00). Mudah dicairkan menjadi cairan tidak berwarna. Ini mencairkannya dengan memberi tekanan pada suhu kamar (suhu kritis 132,4 °C, tekanan kritis 11,2 megapascal, atau atmosfer 112,2). Titik didih -33,5 ° c. Itu juga mudah dipadatkan menjadi padatan seperti salju.
Titik lebur -77.75 °C. Larut dalam air, etanol dan eter. Pada suhu tinggi, itu akan terurai menjadi nitrogen dan hidrogen, yang memiliki efek pengurangan. Ini dapat dioksidasi menjadi oksida nitrat dengan adanya katalis. Ini digunakan untuk membuat nitrogen cair, amonia, asam nitrat, garam amonium dan amina. Ini dapat disiapkan dengan sintesis langsung nitrogen dan hidrogen, yang dapat membakar kulit, mata, dan selaput lendir organ pernapasan.
Sifat kimia
Korosif
Amonia memiliki efek korosif tertentu, dan amonia karbida lebih korosif. Korosi tembaga relatif kuat, korosi baja relatif buruk, dan korosi semen tidak besar. Ini juga memiliki efek korosif tertentu pada kayu. Ini adalah bahan kimia berbahaya, nomor kode bahaya 82503.
Lemah basa
Kesetimbangan kimia berikut hadir dalam amonia:
NH3+H2O===NH3· H2O (Reaksi Reversibel)
NH3· H2O===NH4+ +OHˉ (reaksi reversibel) konstanta ionisasi: K=1.8×10ˇ-5 (25°C)
Oleh karena itu, hanya sebagian kecil molekul amonia yang bereaksi dengan air untuk membentuk ion amonium NH4+ dan ion hidroksida OH-, sehingga lemah basa.
(1) Dapat membuat larutan uji fenolftalein tidak berwarna merah, larutan uji lakmus ungu biru, dan kertas uji lakmus merah lembab biru. Metode ini biasa digunakan di laboratorium untuk menguji keberadaan NH3.
(2) Dapat bereaksi dengan asam untuk membentuk garam amonium. Amonia pekat bertemu dengan asam volatil, seperti asam klorida pekat atau asam nitrat pekat, untuk menghasilkan asap putih. Dalam kasus asam non-volatil (seperti asam sulfat dan asam fosfat), tidak ada fenomena seperti itu. Oleh karena itu, metode ini dapat digunakan di laboratorium untuk menguji keberadaan molekul amonia dalam air. Secara industri, alkalinitas amonia yang lemah digunakan untuk menyerap gas ekor industri asam sulfat dan mencegah pencemaran lingkungan.
Ketidakstabilan
Amonia monohidrat tidak stabil, melihat cahaya, dan mudah terurai saat dipanaskan untuk menghasilkan amonia dan air.
Di laboratorium, amonia dapat diproduksi dengan memanaskan campuran padat kalsium hidroksida dan amonium klorida atau mencampur amonia pekat dengan soda kaustik padat pada suhu kamar, yang mudah dipasang dan dioperasikan, dan konsentrasi amonia yang diperoleh lebih besar, dan efek percobaan “air mancur” lebih baik.
Karena sifat amonia yang mudah menguap dan tidak stabil, amonia harus disegel dan disimpan dalam botol reagen coklat atau gelap di tempat yang sejuk dan gelap.
Mengendap
Amonia adalah endapan yang baik, dapat bereaksi dengan berbagai ion logam untuk membentuk alkali lemah atau hidroksida amfoterik yang tidak larut.
Kompleksitas
Amonia dan Ag+, Cu2+, Cr3+, Zn2+ dan ion lainnya dapat mengalami reaksi kompleksasi, ketika sejumlah kecil air amonia, alkali lemah yang tidak larut dihasilkan, dan ketika amonia berlebihan, zat tidak larut diubah menjadi ion kompleks dan larut.
Reduksibilitas
Amonia menunjukkan sifat pereduksi yang lemah dan dapat dioksidasi oleh oksidan kuat.
Mengoksidasi
Hidrogen dalam keadaan oksidasi +1 molekul amonia menunjukkan oksidasi yang lemah dan dapat mengoksidasi zat pereduksi yang kuat.