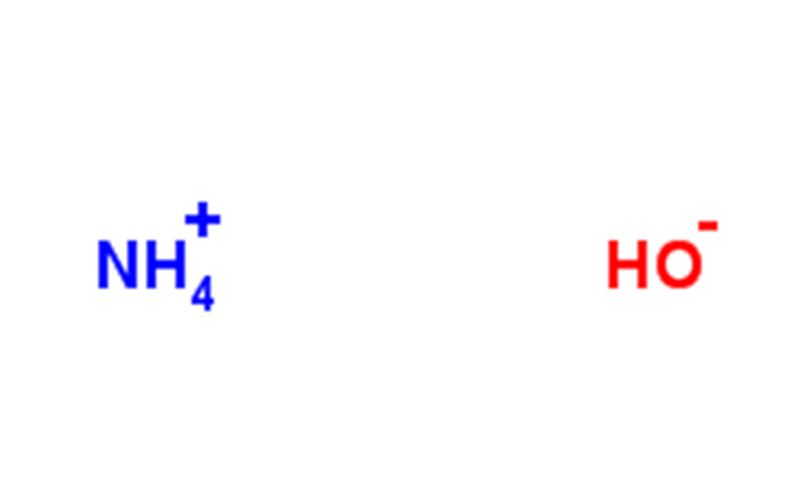Amoniac siêu tinh khiết (dung dịch nước của NH₃) mức ppt
Thông tin chi tiết sản phẩm
| thông số | Hoa Kỳ | tối thiểu | Tối đa | |
| Phòng thí nghiệm (NH3) | % | 28.0 | 30.0 | |
| màu | Appa | 5 | ||
| Clorua (Cl) | Ppm | 0.01 | ||
| Cabonat (CO3) | Ppm | 1 | ||
| Sulfat (SO4) | Ppm | 0.01 | ||
| Phốt phát (PO4) | Ppm | 0.01 | ||
| Chất khử, thuốc tím (KMnO4) | Ppm | 0.5 | ||
| Tạp chất tối đa | Hoa Kỳ | tối thiểu | Tối đa | |
| Nhôm (Al) | PPB | 0.05 | ||
| Antimon (Sb) | PPB | 0.05 | ||
| Asen (As) | PPB | 0.05 | ||
| Bari (Ba) | PPB | 0.05 | ||
| Berili (BE) | PPB | 0.05 | ||
| Bismuth (Bi) | PPB | 0.05 | ||
| Boron (B) | PPB | 0.05 | ||
| Cadmium (Cd) | PPB | 0.05 | ||
| Canxi (Ca) | PPB | 0.05 | ||
| Crom (Cr) | PPB | 0.05 | ||
| Coban (Co) | PPB | 0.05 | ||
| Đồng (Cu) | PPB | 0.05 | ||
| Gali (Ga) | PPB | 0.05 | ||
| Germani (Ge) | PPB | 0.05 | ||
| Vàng (AU) | PPB | 0.05 | ||
| Sắt (Sắt) | PPB | 0.05 | ||
| Chì (Pb) | PPB | 0.05 | ||
| Lithium (Li) | PPB | 0.05 | ||
| Magiê (Mg) | PPB | 0.05 | ||
| Mangan (Mn) | PPB | 0.05 | ||
| Molypden (Mo) | PPB | 0.05 | ||
| Niken (Ni) | PPB | 0.05 | ||
| Niobi (Nb) | PPB | 0.05 | ||
| Kali (K) | PPB | 0.05 | ||
| Bạc (Ag) | PPB | 0.05 | ||
| Natri (Na) | PPB | 0.05 | ||
| Stronti (Sr) | PPB | 0.05 | ||
| Tantali (Ta) | PPB | 0.05 | ||
| Thallium (Tl) | PPB | 0.05 | ||
| Thiếc (Sn) | PPB | 0.05 | ||
| Titan (Ti) | PPB | 0.05 | ||
| Vandi (V) | PPB | 0.05 | ||
| Kẽm (Zn) | PPB | 0.05 | ||
| Zirconium (Zr) | PPB | 0.05 | ||
| Số lượng hạt | Hoa Kỳ | tối thiểu | Tối đa | |
| ≧ 0,1 micron | chiếc / ml | 200 | ||
| ≧ 0,2 micron | chiếc / ml | 50 | ||
| ≧ 0,5 micron | chiếc / ml | 30 | ||
| ≧ 1.0 micron | chiếc / ml | 10 | ||
Tính chất vật lý và hóa học
- Mật độ: ~ 0,88 g / cm³ (ở 20 °C)
- Điểm sôi: ~ 36 °C (thay đổi theo nồng độ)
- Điểm nóng chảy: ~ -77 °C
- pH: Kiềm mạnh (pH >11)
- Độ hòa tan: Trộn hoàn toàn với nước, phản ứng với axit
- Phân hủy: Giải phóng amoniac (NH₃) theo thời gian, đặc biệt là khi đun nóng
Sự khác biệt giữa amoniac và amoniac monohydrat
1. Amoniac monohydrate
Amoniac monohydrat là một chất tinh khiết, công thức hóa học: NH3· H2O, là một bazơ yếu. Amoniac chủ yếu hòa tan trong nước để tạo thành amoniac monohydrat, NH3 + H2O⇌NH3 · H2O。 Nó là thành phần chính của amoniac (amoniac là một hỗn hợp), dễ bay hơi và thoát ra khỏi amoniac. Nó có mùi hăng nồng và có thể trộn lẫn với ethanol. Nó ăn mòn và gây rách. Amoniac monohydrat là một chất điện phân yếu, có thể được ion hóa một phần thành các ion amoni và hydroxit (do đó đôi khi được gọi là amoni hydroxit) trong nước và có tính kiềm yếu: NH₃· H₂O====(NH₄⁺)+(OH⁻)
2. Amoniac
Amoniac, còn được gọi là nước amoniac, chủ yếu bao gồm NH3· H2O, một dung dịch nước amoniac, không màu, trong suốt và có mùi hăng. Amoniac là một hỗn hợp, một hỗn hợp khí amoniac hòa tan trong nước, tức là dung dịch nước amoniac monohydrat. Amoniac công nghiệp là dung dịch nước có chứa 25% ~ 28% amoniac, và chỉ một phần nhỏ các phân tử amoniac phản ứng với nước để tạo thành amoniac monohydrat, là một chất kiềm yếu chỉ tồn tại trong amoniac.
Amoniac chứa các ion NH₄⁺, NH₂⁻, OH⁻ và H₃O⁺. Amoniac monohydrat thu được bằng amoniac monohydrat hòa tan trong nước và Kb = 1,8×10-5 của phản ứng này. Giá trị pH của amoniac 1M là 11,63 và khoảng 0,42% NH₃ trở thành NH₄+.
Sự khác biệt về bản chất
1. Tính chất của amoniac monohydrate
Amoniac monohydrat có tác dụng ăn mòn nhất định. Sự ăn mòn của đồng tương đối mạnh, sự ăn mòn của thép tương đối kém, và sự ăn mòn của xi măng không lớn. Nó cũng có tác dụng ăn mòn nhất định đối với gỗ. Amoniac monohydrat không ổn định và dễ phân hủy để tạo ra amoniac và nước. Do tính chất dễ bay hơi của amoniac, amoniac nên được bảo quản trong chai thuốc thử màu nâu hoặc sẫm màu có nút cao su và đặt ở nơi tối mát.
2. Bản chất của amoniac
Amoniac là kiềm và là một chất kết tủa tốt, có thể phản ứng với nhiều loại ion kim loại để tạo thành hydroxit kiềm yếu hoặc lưỡng tính không hòa tan. Amoniac cũng thể hiện đặc tính khử yếu và có thể bị oxy hóa bởi các chất oxy hóa mạnh. Chỉ một phần nhỏ các phân tử amoniac trong amoniac phản ứng với nước để tạo thành ion amoni NH4+ và ion hydroxit OH-, có tính kiềm yếu. Amoniac có thể phản ứng với axit để tạo thành muối amoni. Khói trắng xảy ra khi khí amoniac bay hơi bởi amoniac đậm đặc gặp sương mù axit bay hơi do axit dễ bay hơi, chẳng hạn như axit clohydric đậm đặc và axit nitric đậm đặc.
Các ứng dụng quan trọng
- Ngành công nghiệp bán dẫn:
- Để làm sạch RCA (SC-1) để loại bỏ chất hữu cơ và ô nhiễm hạt khỏi tấm wafer
- Không thể thiếu trong quá trình khắc và phẳng hóa cơ hóa học (CMP)
- Sản xuất điện tử:
- Chất ăn mòn kiềm có độ tinh khiết cao cho vi điện tử và bảng hiển thị
- Thuốc thử chính trong việc tước chất cản quang
- Tổng hợp hóa học và dược phẩm:
- Để sử dụng trong các công thức hóa học có độ tinh khiết cao
- Tiền chất của các hợp chất gốc amoni trong nghiên cứu và công nghiệp
- Ứng dụng môi trường và phân tích:
- Nó được sử dụng trong sản xuất nước siêu tinh khiết và xử lý nước thải
- Thuốc thử trong ICP-MS và các kỹ thuật phân tích dấu vết khác
Bảo mật và xử lý
Amoniac, Amoniac, NH3, khí không màu. Có mùi hăng nồng nặc. Mật độ 0,7710. Mật độ tương đối là 0,5971 (không khí = 1,00). Nó dễ dàng hóa lỏng thành chất lỏng không màu. Nó hóa lỏng nó bằng cách tạo áp suất ở nhiệt độ phòng (nhiệt độ tới hạn 132,4 °C, áp suất tới hạn 11,2 megapascal hoặc 112,2 atm). Điểm sôi -33,5 ° c. Nó cũng dễ dàng đông đặc thành một chất rắn giống như tuyết.
Điểm nóng chảy -77,75 °C. Hòa tan trong nước, etanol và ete. Ở nhiệt độ cao, nó sẽ phân hủy thành nitơ và hydro, có tác dụng khử. Nó có thể bị oxy hóa thành oxit nitric khi có chất xúc tác. Nó được sử dụng để tạo ra nitơ lỏng, amoniac, axit nitric, muối amoni và amin. Nó có thể được điều chế bằng cách tổng hợp trực tiếp nitơ và hydro, có thể làm bỏng da, mắt và niêm mạc của các cơ quan hô hấp.
Tính chất hóa học
Ăn mòn
Amoniac có tác dụng ăn mòn nhất định, và cacbon hóa amoniac ăn mòn nhiều hơn. Sự ăn mòn của đồng tương đối mạnh, thép tương đối kém, và sự ăn mòn xi măng không lớn. Nó cũng có tác dụng ăn mòn nhất định đối với gỗ. Nó là một hóa chất nguy hiểm và số quy định về mối nguy hiểm là 82503.
Kiềm yếu
Các cân bằng hóa học sau đây tồn tại trong amoniac:
NH3+H2O===NH3· H2O (Phản ứng có thể đảo ngược)
QL3· H2O == = NH4 + + OHˉ (phản ứng đảo ngược) hằng số ion hóa: K = 1,8 × 10ˇ-5 (25 °C)
Do đó, chỉ một phần nhỏ các phân tử amoniac phản ứng với nước tạo thành ion amoni NH4+ và ion hydroxit OH-, vì vậy nó có tính kiềm yếu.
(1) Nó có thể làm cho dung dịch thử phenolphthalein không màu màu đỏ, dung dịch thử quỳ tím màu xanh lam và giấy thử quỳ đỏ ẩm màu xanh lam. Phương pháp này thường được sử dụng trong các phòng thí nghiệm để kiểm tra sự hiện diện của NH3.
(2) Nó có thể phản ứng với axit để tạo thành muối amoni. Khói trắng được tạo ra khi amoniac đậm đặc gặp các axit dễ bay hơi như axit clohydric đậm đặc hoặc axit nitric đậm đặc. Tuy nhiên, không có hiện tượng như vậy trong trường hợp axit không bay hơi (chẳng hạn như axit sunfuric, axit photphoric). Do đó, phương pháp này có thể được sử dụng để kiểm tra sự hiện diện của các phân tử amoniac trong nước trong phòng thí nghiệm. Trong công nghiệp, độ kiềm yếu của amoniac được sử dụng để hấp thụ khí thải công nghiệp axit sunfuric và ngăn ngừa ô nhiễm môi trường.
Instability
Amoniac monohydrat không ổn định, nhìn thấy ánh sáng, dễ bị phân hủy khi đun nóng để tạo ra amoniac và nước.
Trong phòng thí nghiệm, amoniac có thể được sản xuất bằng cách đun nóng hỗn hợp rắn canxi hydroxit và amoni clorua hoặc trộn amoniac đậm đặc với xút rắn ở nhiệt độ phòng, dễ lắp đặt và vận hành, nồng độ amoniac thu được lớn hơn, hiệu quả của thí nghiệm “đài phun nước” tốt hơn.
Do tính chất dễ bay hơi và không ổn định của amoniac, amoniac nên được đậy kín và bảo quản trong chai thuốc thử màu nâu hoặc sẫm màu ở nơi tối và mát.
Kết tủa
Amoniac là một chất kết tủa tốt, nó có thể phản ứng với nhiều loại ion kim loại để tạo thành hydroxit kiềm yếu hoặc lưỡng tính không hòa tan.
Phức tạp
Amoniac và Ag +, Cu2 +, Cr3 +, Zn2 + và các ion khác có thể trải qua phản ứng phức tạp, khi một lượng nhỏ nước amoniac, kiềm yếu không hòa tan được tạo ra, và khi amoniac quá mức, các chất không hòa tan được chuyển hóa thành các ion phức và hòa tan.
Tính giảm thiểu
Amoniac thể hiện đặc tính khử yếu và có thể bị oxy hóa bởi các chất oxy hóa mạnh.
Oxy hóa
Hydro ở trạng thái oxy hóa +1 của phân tử amoniac thể hiện quá trình oxy hóa yếu và có thể oxy hóa các chất khử mạnh.